E23 化学平衡的工业应用:合成氨
目标:说明在日常和世界范围内,如何应用平衡定律,得到最佳的反应条件,从而经济地生产化学品。 |
由化学平衡决定的一些基本知识和基本原理在合成氨工业领域被世界广泛应用。氨是生产量最大的一种化学物质,其年产量可达到约200 000 000吨。
热力学
氨由H2和N2反应得到。该反应的焓增![]() 为-46 kJ/mol NH3,平衡反应如下:
为-46 kJ/mol NH3,平衡反应如下:
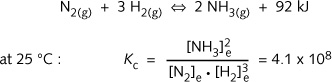
如此高的Kc值,表明由氮气和氢气反应得到氨可以进行得很完全。但是,这个反应十分缓慢,所以在现实条件下,并没有形成氨。这是由于两个氮原子间三键作用使得氮分子具有很高的惰性。热力学量Kc无法预测该反应的速率。
工业生产过程的发展
如何提高该反应的速率?(见图E20中的平衡反应器)
一种方法是提高温度。经验规律指出,温度每升高10°C,反应速率平均可以提高2~3倍(取决于活化能)。这样,温度从25°C升至100°C可能使反应速率提高约1030倍!如此高的温度自然就需要提供很多能量,并且需要特制的反应装置。然而,温度的升高并不能把问题解决,因为放热反应中,随着温度的升高Kc会降低。
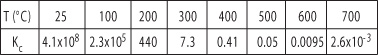
这个反应可以在高温条件下很好地进行,但是这对于平衡条件却是非常不利的!
如何才能使平衡向着 有利于产物生成的方向而不是反应物的方向进行呢?一种方法就是增加反应物的量(比如增加它们的浓度)。 这样平衡就会向有利于产物生成的方向进行。这可以通过如下方法实现:减小反应体积,这就可以提高各组分的分压,从而反应发生时的总压也就提高了。合成平衡反应往往可以通过增加每种反应物的分压使得平衡向有利于产物生成的方向移动。因为四分子的反应物只转化为两分子的生成物,所以平衡向着有利于产物生成的方向移动。
下表给出了在400°C(Kc=0.41)的平衡反应,总压的升高(还有提高分压和起始反应物的浓度)对转化率的影响:
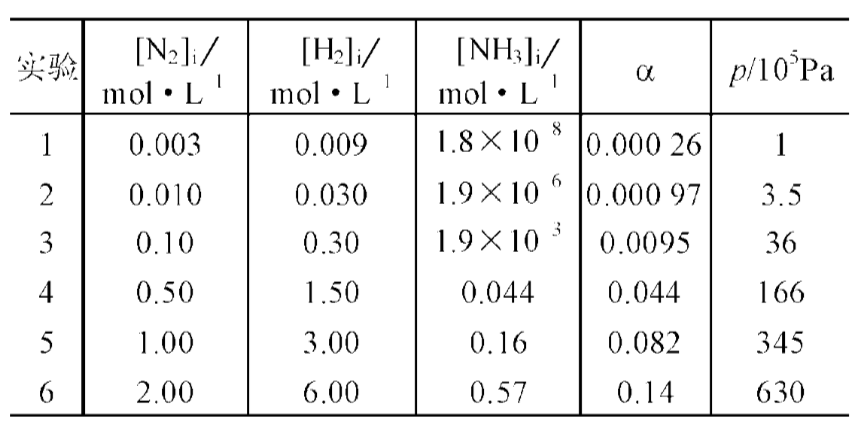
把压强从(1×105Pa)提高到 6.3×107Pa,转化率提高了很多。这为下面的一个问题提供了一个很合理的解决办法——将高温条件得到理想的转化率与高压得到理想的转化率结合起来。然而这种办法却是不可行的,因为高压装置花费大,并且有爆炸的危险。
弗里兹·哈伯(Fritz Haber,1868~1934)和卡尔·博施(Carl Bosch, 1874~1940)针对该负面效应, 进行了更加深入细致的研究,终于提出了一个可行的解决办法——使用催化剂。只需在反应混合物中加入少量的催化剂,就可以加快反应速率,但是并不改变平衡条件。
后来经过深入研究,他们发现在精制铁粉中掺入铝、硅、镁和钾的氧化物可以获得期望的结果。1919年,哈伯因为该发现而获得了诺贝尔奖。催化剂的使用,使得合成氨在低温低压条件下进行成为可能。这降低了装置的成本,增加了该过程的安全性。
当前,1000个反应器平均每天可以生产500吨氨。而催化剂的组成实际上也已经发生了变化(附着在石墨上的钌)。而温度和压力总的来说还是保持不变的:1×107~2×107Pa; 350~500°C。
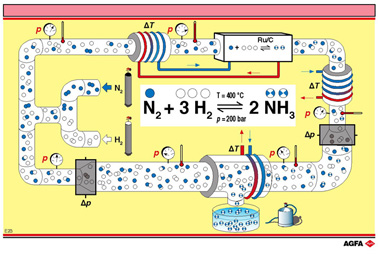
图E23展示了现实中氨是如何合成的。工业生产中,该合成过程并不是在密闭容器中进行的。氨在一个连续的过程中形成,并且最终达到一种稳定的状态而不是一种平衡态。除此之外,平衡定律似乎还可以预测最优反应条件。但是有一点很值得注意,就是合成过程中释放的热量可以用来加热即将参与反应的原料气。这可以充分说明工业生产是多么注意避免能量的浪费!
如何得到反应物的呢?大气中78%的气体为氮气,所以这是一个很好的氮气来源。除去其他气体,就只留下了纯净的氮气,从天然气中得到的甲烷气通常是氢气的来源(参见石油化学和蒸汽裂化模块)。
![]()
这个反应在 NiO-催化剂(由于它的吸热性)存在下,于850°C下进行,平衡常数大约为10,所以无需高压。
该过程的不同阶段可见图E23:
- 混合气体进入反应器,压力升高;
- 气体被加热(温度升高);
- N2和H2通过催化剂床;
- N2和H2部分转化为NH3;
- 释放的热量被移走 (温度压强降低);
- 反应混合物进一步被冷却来压缩制NH3(温度压强进一步降低);
- NH3被移走;
- 释放压力,未参加反应的 N2和H2以及气体混合物被重新用来合成NH3。