E27 能否预测一个反应可以进行完全还是只能达到平衡状态

目标:指出哪些热力学量能解释这个问题。 |
很多科学家会问这个问题:当不同种物质相互反应时,为什么反应往往进行不彻底?
在我们熟悉的NO2-N2O4 反应中,为什么NO2还没有消耗完反应就停止了?
迄今为止,我们仅考虑过平衡反应。而可以进行完全的反应具有什么样的特点呢?如果氯气和过量的氢气混合,爆炸反应就可发生,其中氯气被完全消耗:
![]()
这个反应以及其他一些可以进行完全的反应都是放热反应,![]() 为负值。但是,也有一些吸热反应(
为负值。但是,也有一些吸热反应(![]() 为正)哪怕在室温条件下也可以进行完全。如:
为正)哪怕在室温条件下也可以进行完全。如:
![]()
那么就一定存在一种通用的分类方法,用这种方法可以判定一个反应是否可以进行完全。无需深究推导过程,对于特定的反应混合物,定性和定量地决定反应驱动力的关系式如下:
![]()
这里,![]() H和
H和![]() S为分别在绝对温度T(单位为K,开尔文)条件下,某封闭反应体系的焓变和熵变。
S为分别在绝对温度T(单位为K,开尔文)条件下,某封闭反应体系的焓变和熵变。![]() G是吉布斯自由能变(增加),在一个化学反应中,如果新条件下体系有更高的混乱度,那么熵就会增加。这种情况适用于有新分子生成的反应,并且体系更趋于无序(如:状态改变的结果)或者温度升高。
G是吉布斯自由能变(增加),在一个化学反应中,如果新条件下体系有更高的混乱度,那么熵就会增加。这种情况适用于有新分子生成的反应,并且体系更趋于无序(如:状态改变的结果)或者温度升高。
NO2的二聚化和NH3的合成都导致有序度增加!
大体上,对最初提出的那个问题可以回答如下:在一个封闭反应器中发生的化学反应都朝着反应混合物吉布斯自由能降低的方向进行。这也就是向环境释放热量和体系无序度增加的方向。据此分类法,结合![]() H和/或
H和/或![]() S可以确定四种化学反应类型:
S可以确定四种化学反应类型:
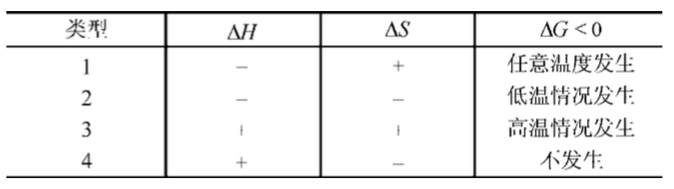
通常,不论反应温度如何,1型反应都可以进行完全。而对于2型和3型反应,其平衡位置由反应温度决定,并且在绝大部分情况下反应不能进行彻底。
放热平衡反应的例子有NO2的二聚化和NH3的合成。吸热平衡反应只有在高温下才可以达到高的转化率。
无论反应温度如何,4型反应的DG往往为正值。这种反应并不是不可能发生的,只是它不能自发进行。必须源源不断地提供能量以保证反应的持续进行,如水的电解。
反应向着吉布斯自由能降低的方向进行,另一方面就是无需外界提供能量反应就可进行。
对于2型和3型反应的平衡条件讨论得还很少。
给定温度下的平衡常数K与该温度下的摩尔吉布斯自由能相关,关系式如下:
![]()
这里,R为8.314J/mol.K,T为热力学温度,单位是 K。
![]() (标准状况下的摩尔吉布斯自由能变)的数值可以由反应物和生成物的一些相应的热力学数据来进行计算。
(标准状况下的摩尔吉布斯自由能变)的数值可以由反应物和生成物的一些相应的热力学数据来进行计算。
可以利用最后一栏的数据来计算NO2二聚化的吉布斯自由能变,也就是N2O4的生成吉布斯自由能:

这里,下标f代表生成。
![]()
从而得出K为9.2。
如果此处的热力学数据是气相反应的数据,那么这里得到的 K值是Kp值。
我们可以按照下面一个式子将气体的分压转换为浓度,那么就可以由Kp得到Kc。著名关系式:pV = nRT[p是压强(Pa),V为体积(m3),n是气体的物质的量(mol),R是摩尔气体常数,T是绝对温度(开尔文)]将压强和浓度联系在一起我们可以得到下面的关系式:
![]()
如果我们把常数值代进去,就可写出下面的式子:
![]()
这里,B=0.08206(L·bar)/(mol·K)(为简单起见,这里我们略去了单位)。最后一个方程式可 以用来把Kp转换为Kc,通常下面的关系式较常用:
![]()
这里,![]() v 是反应物和生成物的化学计量系数的差值,在 NO2 的二聚化中,
v 是反应物和生成物的化学计量系数的差值,在 NO2 的二聚化中,
![]()
对于NO2的二聚化,利用这个表达式计算得到的值为225,与实验所得值222非常吻合。
如何预测一个特定的反应可以进行完全还是只能达到平衡?
从上面的讨论中,我们就可以很明显地看出,热力学数据,如![]() Gm以及K并不能说明一个反应能否进行完全或是进行得快慢等等。
Gm以及K并不能说明一个反应能否进行完全或是进行得快慢等等。
但是通过它们,我们可以知道如何提高转化率或是在合适的激化后,反应可以自发地进行。
转化率和K值间的关系取决于反应的起始组分。另外,K对于平衡常数的表达式也是十分重要的。
尽管如此,对于某些反应类型,可以用下表定性地将![]() 和K联系起来。
和K联系起来。

注意:
利用这些热力学量不能预测动力学行为。所以,在室温条件下,NO2的二聚化可以自发地进行,并且该反应是自发起始的。而N2和 H2不能在室温下进行,尽管合成氨的![]() Gm更负一些,在催化剂存在的条件下起始反应仍需要很高的温度。
Gm更负一些,在催化剂存在的条件下起始反应仍需要很高的温度。
图27左边部分显示了在NO2的二聚化过程中,吉布斯自由能G°是如何变化的。在室温和一个大气压的条件下,以2mol NO2或1mol N2O4开始反应,无论是NO2转化为N2O4,还是NO2分解为N2O4,G°都是降低的,尽管2mol NO的Gd比1mol NO的G°高。这种情况发生是因为由于混合物的生成使熵值增加,这也被称作“混合熵”。
混合熵以![]() 来表示,它为正值,因为混合物比纯净物的无序度高。对于这个混合的过程
来表示,它为正值,因为混合物比纯净物的无序度高。对于这个混合的过程![]() 也为负。通过这种方法,在该特定情况下,混合物中的二聚体的含量相对较大,可以得到
也为负。通过这种方法,在该特定情况下,混合物中的二聚体的含量相对较大,可以得到![]() 的最小值。平衡会向右移动,利于二聚体的生成。在平衡混合物中二聚和解聚反应已经停止,达到稳定的最小
的最小值。平衡会向右移动,利于二聚体的生成。在平衡混合物中二聚和解聚反应已经停止,达到稳定的最小![]() 值。
值。
然而,G和组分数量的相关性很大程度上随着温度和压强的变化(偏离标准态条件)而变化。这种情形在图27(基于图6的实验D)的右侧有所展示。在1×104.Pa的压强条件下,转化率(0.5)还是很低的。