S28 构造原理(填充规则)
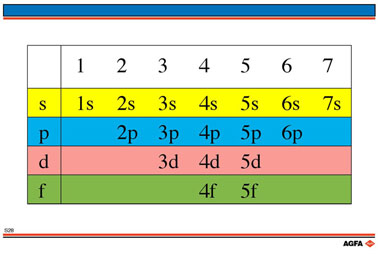
目标:说明构造原理(填充规则),确定电子构型。 |
没有图 S1 时最好使用本图,教师可根据下图中的箭头来说明:
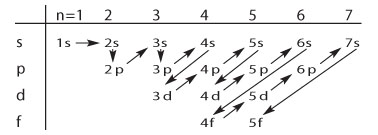
沃尔夫冈·泡利(Wolfgang Pauli,1900~1958)第一次提出这种轨道填充顺序。每个轨道都是分立的,但是每个轨道都最多只能容纳一对自旋相反的电子。电子按照构造原理(填充原则)排布到原子轨道上,首先填充能量最低的轨道。一个电子层中或亚层中的所有轨道能量相同。
同一n值下,轨道能量升高的顺序为:
s -> p -> d -> f.
对高能级轨道,偶尔会发现不符合填充规则的情况。例如,按照填充规则,
Ac的电子构型应该为7s2 6d1 而非
7s2 5f1: 各个壳层的能级之间发生了交错。
参考书目:
R. H. Petrucci and W. S. Harwood, General Chemistry, Principles and Modern
Applications, Macmillan, New York (1989).