S30 - S31 第一电离能
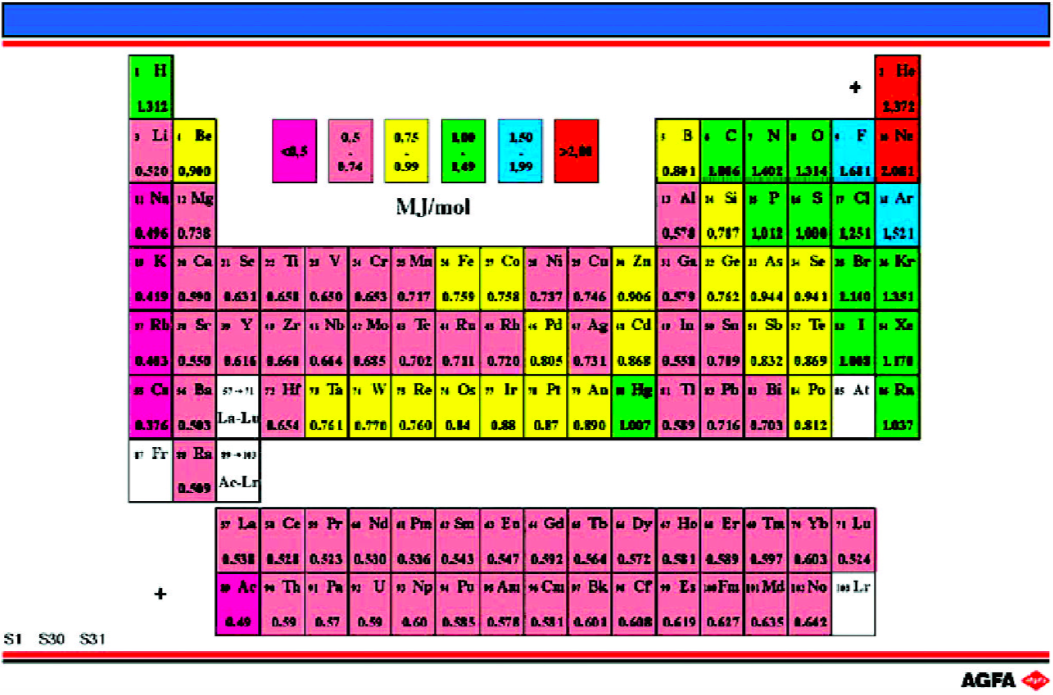
目标:说明第一电离能如何随元素在周期表中的位置而变化。 |
由图中色标可以看出周期表中相邻元素的电离能差别很大。
第一电离能指:1 mol某元素基态的气态原子失去1 mol最外层电子所需要的能量:
A(g) -> A+(g) + e-
A(g) 代表某元素的基态气态原子。 电离能数据单位为MJ/mole.
通常情况下,周期表中每一族从上到下,每一周期从左到右,第一电离能逐步下降。
但是,有三组元素明显例外:
- 稀有气体(除了He),其电子结构为ns2np6,因而具有很高的电离能。
- 元素Be、Mg、Zn、Cd和Hg,其最外电子层的s轨道全充满。
- 元素Np和As,其最外电子层的p轨道半充满。
说明:
可用电子亲和能进行同样的讨论。电子亲和能指:向基态原子添加一个电子的过程中所发生的能量变化。可用下式表示:
e- + A(g) -> A-(g)
由于电子亲和能随周期表中元素位置变化的规律不明显,因此,这里不讨论电子亲和能。
参考书目:
1) C. E. Mortimer, Chemistry, Wadsworth Publishing Company, Belmont, California.