M17 能量最低原理和轨道能级
|
目标:表示轨道能级并解释能量最低原理。 |
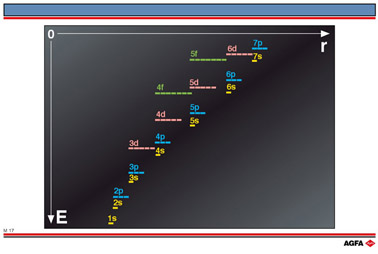
图 M17 表示轨道能级是r的函数(r为由核到电子的距离),或者说,由小变大的整数主量子数n与能级(例如1s、2p 或5f)有关。主量子数n为整数,它通过以下表示式决定电子在允许轨道上的角量子数
![]()
[式中的整数 n 描述了氢原子发射光谱线系列的波长,见图 M09和M10的说明。]
原子中一个电子的能量可以用4个量子数来表征:
- 主量子数n,为整数;
- 角量子数l,取整数值0,1,2,3,⋯,(n-1);
- 磁量子数m,取整数值-l,-(l-1),-(l-2),⋯,0,⋯,(l-2),(l-1),l;
- 自旋量子数s,取值 +1/2 和- 1/2。可将电子看成像陀螺一样,绕轴顺时针和逆时针旋转。
泡利(Wolfgang Pauli 1900~1958)第一次提出这种填充轨道能级的方法。他在“排斥理论”中提出, 一个原子中不可能有两个电子的4个量子数完全相同。换句话说,在任一原子中,不可能有两个电子具有 完全相同的行为。如果认为氦原子处于最低能量状态,它的两个电子应该取相同的量子数n = 1、l = 0、m = 0。这意味着,按照泡利不相容原理,这两个电子的第四个量子数(自旋量子数)必不相同,即一个电子的自旋态为 +1/2,另一个的则为- 1/2。自旋相反的一对电子以如下符号表示:
![]()
按照洪特规则,电子先单独占据每一能级,然后才发生配对。
根据能量最低原理,可用的电子按轨道能级增加的顺序,成对填入可用的轨道中。主量子数n相同的轨道, 如2s和2p轨道,以及3s、3p和3d轨道,轨道能级按如下顺序升高:s< p< d< f.
一个特定电子层或电子亚层(具有相同主量子数和角量子数的一组轨道)中的所有轨道具有相同的能量。例如3个2p轨道的能量相同。
较高的能级可能不服从能量最低原理。例如,Ac为 7s2 6d1而不是
7s2 5f1,原因是各种能级间发生了相互交错。
参考文献:
C.E. Mortimer, ‘Chemistry’, Wadsworth Publishing
Company, Belmont, California.