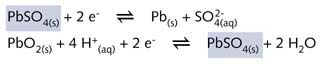R15 铅酸蓄电池
目标:描述铅酸蓄电池的构成、工作原理及特性。 |
蓄电池,通常也叫电瓶,是一个应用电化学反应的典型例子。它是一种储存或积累电能的电化学电池,由阳极和阴极化学物质构成,两极用电解质溶液或糊状电解质相连接,阳极和阴极之间还有多孔的隔板或盐桥。
如果阳极和阴极之间放一个电阻,例如马达或灯泡,通过一个自发的电子转移反应,化学能将转化为电能。蓄电池就是一种化学电源。
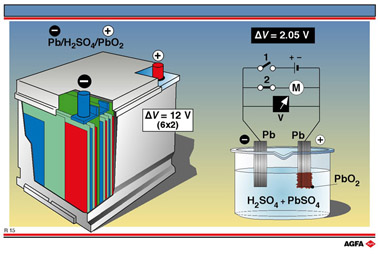
电池和蓄电池是现代生活方式中一个非常重要的部分。它们可以小到手表里装的纽扣电池,大到又大又重的医院、船舶和车辆用应急电源。通常,电池和蓄电池是根据某一特定用途来制造。在汽车和卡车上,铅酸蓄电池广泛用作化学电源。一种铅酸蓄电池的构成和工作原理示于图R15。
铅酸蓄电池的构成
这种铅酸蓄电池有一个聚丙烯外壳,内装六个串联起来的铅酸电化学电池,每个电池的电动势为2V (2.05 V)。铅酸蓄电池的功率变化范围很宽,但它的电压总是2 V的倍数。也可以用多个多孔聚乙烯隔板把每个电池分隔开。在单个电池中,所有的阳极和阴极都相连,即一个电池的阳极和下一个电池的阳极,再一个电池的阳极一个个连起来,电池的阴极也这样连起来。
所有阳极全是铅制的,所有阴极全是嵌在铅基板上的固体铅(IV)氧化物即二氧化铅。电池的导电杆也是铅制的。电解质是用PbSO4饱和的80%硫酸溶液。
铅酸蓄电池中的电化学
放 电:
放电时,相关电极反应发生在负极上(现在是阳极):
![]()
a在正极上(现在是阴极)
![]()
现在电池就是一个电化学电池。通过右上方物质与左下方物质之间的自发氧化还原反应,产生电流。
![]()
当浓度和温度处于标准状态时,蓄电池中每一个隔间对应一个电池的电动势。
![]()
在使用中,铅酸蓄电池的效率逐渐降低。主要的氧化还原反应(也有其他反应)消耗硫酸。由于电解质溶液的密度是随硫酸浓度增大而增大的,效率下降将造成电池中酸的密度减小。通过测量电解质溶液的密度(比重),可以检测蓄电池的效率。
充电:
由于氧化还原反应的可逆性,铅酸蓄电池有着合理的寿命。
![]()
其可逆反应为:
![]()
以再生放电过程中所用的物质。只有从某外部能源(例如汽车的交流发电机或直流发电机,或者接在电力网上的电插头)连续获取动力,才能进行充电。随着电池获得电流, Pb2+在电极上的)被还原为
金属铅,同时,在 PbO2 电极上,Pb2+ 被氧化成PbO2. 铅和PbO2 都沉积到电极上。
充电和放电过程中的半电池反应完全一样,但是,充电过程涉及较弱的氧化剂(左上方)和较弱的还原剂(右下方)。