CB05 共振结构,氧化数和形式电荷
目标:说明分子的电子结构并不总是以一种方式即可正确表达。 |
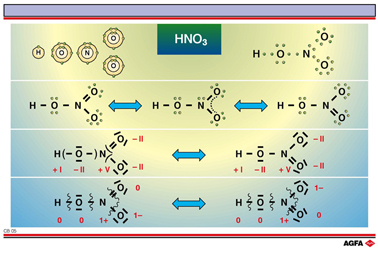
路易斯结构式不能给出分子的完全真实的结构,它仅强调了分子的某些方面,例如分子中成键电子和孤对电子可能的分布情况。以HNO3为例,在中心氮原子周围有三个氧原子。一个氢原子连在其中一个氧 原子上。如果观察路易斯结构,我们可以发现有三种不同的氧原子。氧原子1有两个正常的共价单键:一个与氢原子相连(△EN=1.4),另一个与氮原子相连(△EN=0.5)。
氧原子2以一个双键与氮原子相连(s 和 p 键, 见图解CB 19)。
由于氮原子的孤对电子和氧原子3共享,因此氧原子3达到稀有气体结构。这是极性键的给体-受体类型(N∶给体;O∶受体),它的成键电子对是由成键原子中的一个原子(在这里是氮原子)提供的。
多重键总是比单键短。因此,测定键长可以确定一个化学键到底是多重键还是单键。
为了用路易斯结构说明这一点,要写出这两种极限结构。它们被叫做HNO3 分子的共振结构。
我们也可以给出一个化合物中每个原子的氧化数。化合物或离子中的一个原子的氧化数(ON)是指形成化学键时,这个原子完全或部分失去电子(正氧化数),或者是完全或部分得到电子(负氧化数)的数目。氧化数ON的数值通常用罗马数字表示。
对氧化数ON来说,是否存在稳态结构并不重要。在 HNO3分子中,每个氧原子的氧化数是-II,氮原子的氧化数是+V,氢原子的氧化数是+I。在中性化合物中,氧化数的总和是0。
如果一个分子具有给体-受体型共价键,那么一个特定的原子会带有净电荷。氮原子用自己的两个电子与氧原子成键。在正常的共价键里,每个原子贡献一个电子来形成共用电子对。而在这种情况下,氮原子把一个电子给了氧原子以形成成键电子对。最终,氮原子失去了一个电子:形式电荷为+1;氧原子得到了一个电子:形式电荷为-1。
在这两种共振结构中,两个氧原子的形式电荷是不同的。在化学的一些分支学科中,路易斯结构和中介结构中的氧化数和形式电荷是很重要的。
氧化数在氧化还原反应中起着重要作用(见电化学部分 DIDAC-3)。形式电荷在有机化学反应机理的研究中也是很重要的。