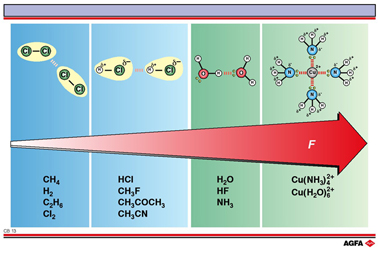
CB13 分子间作用力的类型
|
目标:对最重要的分子间作用力的概述。 |
术语“范德华力”常用来描述中性分子之间的吸引作用,在插图中用蓝色区域表示:如果存在范德华力,总是色散力+偶极-偶极和其他多极子作用力。
氢键的相互作用能大多是 ~20 kJ mol-1, HF2- (155 kJ mol-1) 和 HCl2-, HBr2- 和 HI2- (~ 50 kJ mol-1) 例外。这种相互作用能明显低于“强”的化学键(100-500 kJ mol-1) 但比“弱”的范德华相互作用力强(0.1 – 5 kJ mol-1)。氢键可导致大的动态的分子聚集体,它可以在不破坏分子基本结构的条件下断裂 (例如水)。氢键在决定物质的物理和化学性质上起着非常重要的作用。离子-偶极相互作用的强度可以与氢键相比拟。