E15 酸碱平衡:缓冲溶液
目标:说明在弱酸和其对应盐的混合溶液(即缓冲溶液)中,当加入相对较大量的强碱时,溶液的氢离子浓度和pH变化很小。 |
在自然界中,酸、碱、盐的混合物通常存在于水中,而不是单独的酸或碱。幸运的是在许多情况下,
这样的复杂体系能简化成简单的平衡反应,其中H3O+和OH-的浓度都能计算出。
通常这是强酸或强碱的解离反应。这也就可用于缓冲体系,也就是所谓缓冲溶液。
缓冲溶液包含一种弱酸和相应的弱酸盐,或者一种弱碱和相应的弱碱盐。
称其为缓冲溶液,因为它有能力保持溶液的pH在某一个相对稳定的范围内,即使加入了相当量的强酸或强碱。
我们身体内的血液就是一个缓冲体系。这是很幸运的,因为许多由酶催化的生化反应只能在一个很窄的pH范围内进行,而体内血液的pH必须保持在7.35和7.45之间。
如果不是这样,就会对酶和细胞膜有很多损害。我们的血液必须保持微碱性。pH低于6.8或高于7.8就会引起死亡。
为了简化,可以认为血液的pH主要由碳酸(H2CO3,一种弱酸)和碳酸氢根(![]() ),存在于钠盐或钾盐中调控。
),存在于钠盐或钾盐中调控。
以下三个平衡反应能帮助理解碳酸缓冲剂以及其他大多数缓冲剂的工作原理:
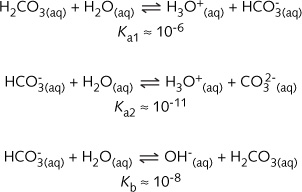
第一个反应涉及到碳酸的第一步和第二步电离(解离)反应。在给定的生理温度37°C下,这两步的Ka 值分别是 Ka1 和 Ka2。
第三个反应涉及碱的平衡反应或者![]() 在水中的水解(有相应的K)。
在水中的水解(有相应的K)。
因为 Ka1 值比其他两个酸碱反应的平衡常数至少大上百倍,因此这个平衡占支配地位。
![]()
pH = 7.4是健康血液的正常pH,即[H3O+]e = 10-7.4,,意味着盐/酸浓度比例必须是20。而实际浓度是0.0240 mol/L和0.0012 mol/L:

血液对抗酸的缓冲行为特别有效,例如,当药物在静脉内发生作用时会流入酸。
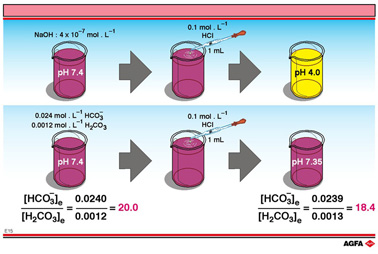
在图E15中,描述了两个实验,论证了与血液相似体系的缓冲能力。前一个实验中,烧杯中装有 100 mL的氢氧化钠溶液,pH为7.4;而后一个实验中,烧杯中装有100 mL的碳酸缓冲溶液,pH也为7.4。然后都加入溴甲酚紫指示剂,原来无色的溶液变成紫色。
按照图中的描述,接着加入0.1 mL 0.1mol/L的盐酸,前一个实验中,装有NaOH溶液的烧杯变成黄色,然而后一个实验中,缓冲溶液颜色仍然不变。
解释(粗略计算):
在加入盐酸之前,100 mL(pH为7.4)溶液中存在的氢离子为4x10-9。当10-5mol的氢离子加入氢氧化钠溶液时,部分被氢氧根中和,但这些量可忽略不计。因此,pH应该决定于100 mL溶液中存在
的10-5mol的H3O+,也就是浓度为10-4mol/L。因此,pH为4。在这个pH下,溴甲酚紫呈浅黄色。
另一方面,100 mL缓冲溶液中存在0.0024 mol的![]() 。加入的氢离子前,大约10-5mol的
。加入的氢离子前,大约10-5mol的![]() 被质子化为碳酸。
被质子化为碳酸。
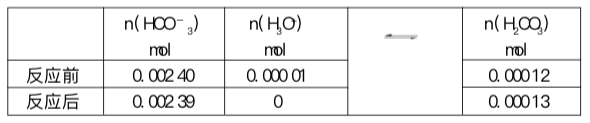

H2CO3对![]() 的新比率是0.0544∶0.05。此时对应的pH是7.36。对我们的血液而言,这个pH变化当然是可以承受的。
的新比率是0.0544∶0.05。此时对应的pH是7.36。对我们的血液而言,这个pH变化当然是可以承受的。
缓冲体系保持pH的功能,不仅在血液、其他体液和细胞起着重要作用,在大量的非生化和工业过程中也很重要。海洋、湖泊、尿,甚至土地,都是巨大的缓冲体系。因此酸雨对这些缓冲体系来说应该不是什么问题。但是,它们的缓冲能力却不是无限的。