E16 多相平衡:难溶离子化合物生成可溶性产物
|
目标:阐明基本的平衡定律是如何像适用于均相平衡一样适用于非均相平衡的,例如在饱和溶液中,水相中难溶离子和沉淀中离子化合物之间的平衡。 |
迄今为止,无论是气相还是液相反应,我们仅考虑过均相平衡的反应。实际上,存在着很多非均相反应,在混合物中至少有存在两相。我们将讨论两个非均相平衡反应的例子:一个是固液反应体系(以水为主的液相),一个是固气反应体系。
固 - 液非均相平衡反应
某些化合物易溶于水,而另一些就不溶。碱金属以及含有铵根离子的盐类全部都易溶于水,而阴离子对其溶解性几乎无影响。难溶化合物往往都是一些弱酸盐,但弱酸根的碱金属盐和铵盐除外。硫酸钡就是一种难溶盐。它是病人在做肠道X光片时必须喝的一种白色悬浮液的重要成分。
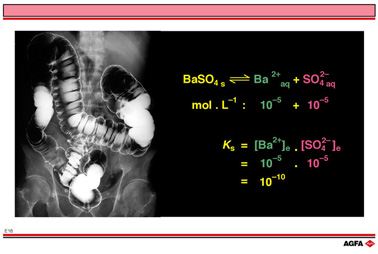
图例E16示出了内有硫酸钡悬浮物的肠道的部分X光片,硫酸钡可以强烈吸收X射线,肠的轮廓和形状就可以显示出来,大夫才能依据此进行诊断。因为钡盐是有毒的,所以当BaSO4在肠道里时,必须防止钡离子向肠壁的扩散。
因此,当照完X光后,通常要立即进行一次清理处理。用这种方法就可以避免有毒的钡离子被吸收入血液中。另外,硫酸钡悬浮物可以和从肠道的悬浮液相分离,于是黏稠糊状物可以固化。
溶度积
在悬浮物中存在多少钡离子呢?
如果在室温下向纯净水中加入足量的硫酸钡的白色晶体并长时间搅拌此混合物,一旦停止搅拌,几乎所有的硫酸钡都会沉淀在烧瓶底部。从而出现了两相:固相和其上方的水相——组成了非均相体系。由Ba2+和![]() 组成的晶态化合物是微溶的,两种离子间的库仑力也因为与水的相互作用而被削弱。这样,溶解4和沉淀的过程就会不间断地进行(非均相平衡是受动力学控制的)。留在溶液中的平均离子数由如下的平衡方程式决定:
组成的晶态化合物是微溶的,两种离子间的库仑力也因为与水的相互作用而被削弱。这样,溶解4和沉淀的过程就会不间断地进行(非均相平衡是受动力学控制的)。留在溶液中的平均离子数由如下的平衡方程式决定:
![]()
该方程式对应于如下的非均相平衡反应:
![]()
请注意在平衡常数(Ks而不是Kc)中,固相的浓度并没有出现。这是上述提到的公认的国际惯例的结果。溶度积的物理意义是什么?
DIDAC-1中图例H8有更详细的阐述。
室温条件下的溶度积确定了平衡式中Ba2+和![]() 浓度的乘积恒为常数1.1 x 10-10.
浓度的乘积恒为常数1.1 x 10-10.
如果Ba2+和![]() 仅来自硫酸钡,Ba2+的浓度大约为10-5 mol/L,即每10 000 000个水分子中有一个钡离子,这样低浓度的钡离子是允许的。
仅来自硫酸钡,Ba2+的浓度大约为10-5 mol/L,即每10 000 000个水分子中有一个钡离子,这样低浓度的钡离子是允许的。
ð 有时,溶液中组成溶度积的除了钡离子和硫酸根离子外还有其他的离子;
ð 通常离子还会和水发生酸碱反应(水解)。在这个反应中硫酸根离子就存在水解问题,但微弱到可以忽略的程度(
这样就可推断这两种通过计算得到的平衡浓度是相当精确的。
固 - 气非均相平衡
除了一些在水中发生的非均相平衡反应外,还有一些基于某些固体分解的非均相平衡反应(多数发生在较高温度下),其中一个比较有趣的例子就是碳酸钙的分解反应。
CaCO3是一种含量很丰富的矿物,并且是一种大量使用的化学原料矿物,常以白垩、大理石形式存在,与碳酸镁同共存于白云石中,等等。许多海洋贝壳以及许多种学校用的粉笔中都含有碳酸钙。
CaCO3也常被用作牙膏也可以用于清洗产品的研磨剂。有时它被洒在草坪和草地上来降低土壤的酸性。
碳酸钙也是一种重要的重工业原料。它是生产CaO(生石灰)的原料,而生石灰自身被用于水泥的生产中。它是碳酸钙在石灰窑中以1000°C以上的温度煅烧产生的。
在这个温度下,碳酸钙按如下平衡反应式分解:
![]()
每个温度下具有不同的平衡条件:
![]()
25°C条件下的平衡常数表明:在多佛和加来的白垩石是经过了多少年才形成的啊