T04 热力学第二定律
目标:说明热力学第二定律,并定义熵变。 |
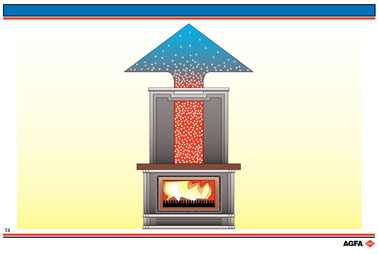
在图T4中,可以看到,火焰产生的热气体在烟囱中升起,并扩散到周围环境中,与其他气体混合。因此,由烟囱冒出的热气体被冷却,同时周围的气体被加热,热量的散失自动产生。而相反的过程——环境中的热气体自动分离出来并回到烟囱中——却不会发生。
热力学第二定律定义了过程或事件发展的方向。凭着本能,我们觉得热量应该从热物体流向冷物体。
这个原理可借助熵和熵变的概念,用数学方法来表示。熵S是描述一个状态(在某种条件下)混乱度的函数。所以,当体系从一种状态改变到另一种状态时,熵变ΔS 表征体系混乱度的变化。
T (K) = t(°C) + 273.15.
(有时简化为273)
对图 T4 的例子,有:
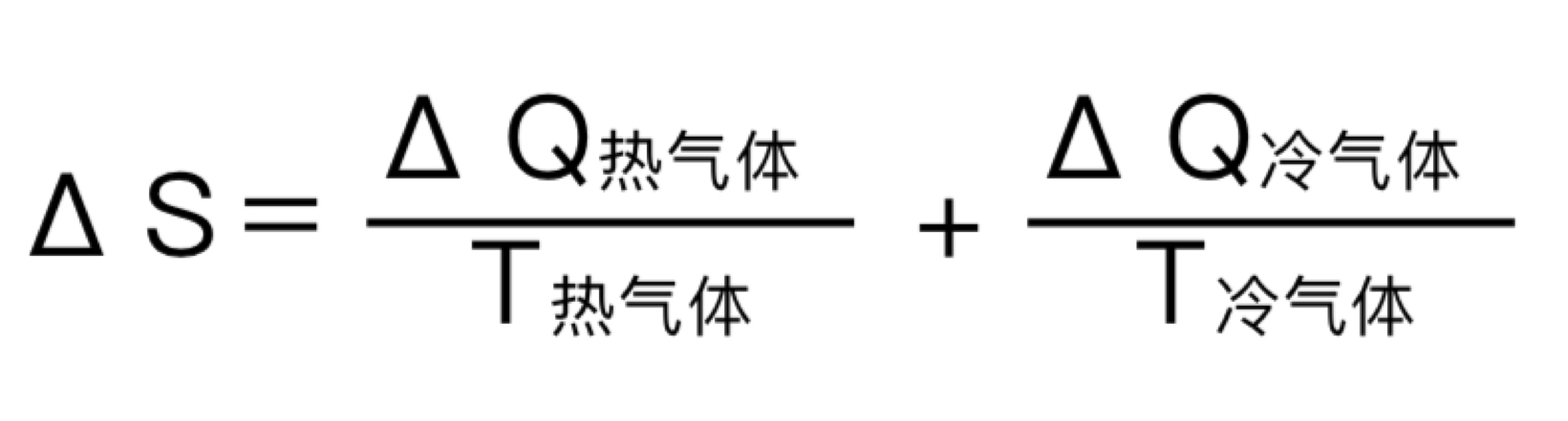
在孤立体系中,熵变ΔS ≥ 0。 根据热力学第一定律,热气体损失的热量应等于冷气体获得的热量,而且热气体的绝对温度要比冷气 体高。从上面的等式可以看出:当热气体损失热量时(ΔQ 为负值),ΔS 是正值;当冷气体与热气体温度 相等时,ΔS = 0,也就是说体系处于平衡状态。
以上讨论并不是说熵减少的过程不存在,但这样的过程只有在外部向所讨论体系提供能量的时候才会 发生,即系统不是孤立体系。
提示:
由浴池中冷热水的混合很容易说明热力学第二定律。每当向已装有冷水的浴池中注入热水时,热水自 发地与周围的冷水混合在一起。热水温度不断下降,同时冷水温度逐渐上升,直到达到所需温度。根据热 力学第二定律,相反的过程,即让已达到所需温度的水自发地分为热水区和冷水区是不可能的。