E02 浓度和反应速率对时间的变化
目标:在一个不完全进行的反应中,用图示法说明各组分浓度和各反应速率随时间是如何变化的。 |
我们先考虑上面实验中容器A中的混合气体。因为铜和硝酸反应放出的热量会加热NO2, 而阻止 N2O4的生成,所以新充入容器中的气体主要是NO2(见E12图解释)。
仔细观察,将会注意到气体颜色逐渐变浅,表明红棕色的NO2 逐渐转变成无色的N2O4。
不完全反应中的浓度变化
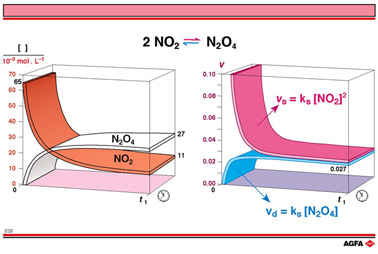
NO2 和 N2O4 的浓度随时间的变化进度在图E02中用左边的曲面表示。在图中用红棕色线表示的NO2浓度逐渐降低,反映为气体颜色变淡,而白色线表示的N2O4浓度逐渐升高。
奇怪的是,从剩余的颜色可以看出 NO2浓度没有减少到 0,因此 N2O4浓度也没有达到最大可能值。从t1, 时间以后,NO2浓度维持0.011 mol/L 不变,而 N2O4浓度则为0.027
mol/L。
这与到达某一点后混合反应几乎不再进行一致,在这一点后颜色不再变化。残留的颜色表明还有残留的NO2存在。
这种不能进行完全的反应被称作平衡反应,其中反应物和生成物浓度不再变化表明反应在完全进行前 已经停止了。尽管进一步反应所需的化学成分都存在,但是反应已不继续进行了。
在这一点反应物和生成物的浓度都被称为平衡浓度,用[]e表示。在化学反应中用双箭头表示平衡反 应,一个(上面的)指向产物,而另一个(下面的)指向反应物,正如下面列出 NO2的二聚反应:
![]()
化学计算
为了得到浓度为0.027 mol/L 的N2O4(起始浓度为0mol/L),需要0.054mol/L的NO2 参与二聚化,将此浓度和NO2
的剩余浓度0.011 mol/L加起来就是初始NO2浓度0.065 mol/L.
转化
在描述平衡反应中一个重要的量就是所谓的转化率,用符号a表示。转化率用百分数表示时可简单地写作a ×100。转化率可以定义为某反应物减少的量除以其起始量。因为在反应过程中反应容器的体积不会改变, a能用任何量(物质的量、浓度、质量)和任何单位表示。在这个实验中,NO2浓度的减少是0.054 mol/L(2×0.027 mol/L),NO2起始浓度是0.065 mol/L。
因此,a= (0.054/0.065) = 0.8。
对于转化率在0.50以上的反应,平衡在反应方程式右侧;而转化率在0.50以下的,平衡在反应方程式左侧。此外,应该注意到转化率经常用由化学计量关系确定的反应物来表示。
图 E02 左侧的图,只是给出气体浓度随时间变化的近似概念。
到达t1 时,混合气体的颜色不再发生变化而指示反应达到平衡,这一时间被称为平衡时间,这个时间并不随着反应物初始量和其他反应条件的改变而变化。
t1 是决定化工过程经济效益的一个重要的量,因为它能决定设备用于特定工序的时间。
在图 E02 的右图中,N2O4合成反应速率vs及分解速率vd与对应反应时间是用绘图表示的。反应速率在数学上并不完全是正确的,因为这幅图是基于模拟程序用适当的动力学公式、实际浓度和相对速率常数ks (N2O4合成)
and kd (N2O4分解)绘制的。
然而,它仍很好地表示了在N2O4合成和 N2O4分解过程中反应速率的变化关系。尽管展示出来的两个过程有相同的t1,并不严格正确。
我们想要说明所指的“合成速率”和“分解速率”与“反应速率”不同。反应速率被定义为一种反应物或生成物浓度变化除以相应的时间跨度。
从图中能得到最重要的信息就是在平衡时间合成速率和分解速率相近。
依据质量作用定律,vs 和 vd,
分别用来表示反应物和生成物的反应速率,可以用浓度的指数m和n以及相应的速率常数ks和 kd来表示。指数m和n必须由实验测得,因为它们与反应机理密切相关。事实上,在这个例子中实验测得的指数m和n分别是2和1。
反应速率vs和 vd能可写成:
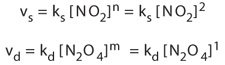
平衡时,反应物和生成物的浓度都不再变化,也就是达到了所谓的“平衡状态”。可以假定认为正反应速率vs和逆反应速率 vd相等:

反应完全
如果二氧化氮二聚化作用完全的话,那么NO2浓度将会由初始的0.065 mol/L变为0,最终N2O4浓度将会是0.0325 mol/L,并且反应速率也将为0。