E03 - E04 平衡反应的可逆性
目标:说明不论初始时反应物和生成物浓度为多少, |
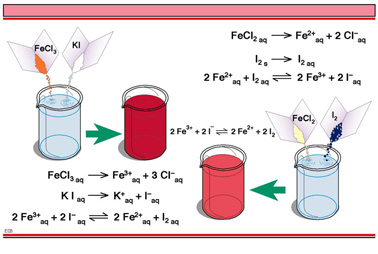
图E03展示的实验阐释了两个化学平衡的深层面问题:无论反应是始于反应物还是产物的反应均存在 可逆性,论证平衡混合物中反应物和生成物的存在关系(见图E05)。
在水中(用aq表示)的总反应能写成以下形式:
![]()
用反应物开始实验
1 g赭色三氯化铁固体(用s表示)溶解于100 mL蒸馏水得淡赭色溶液。然后加入1g白色碘化钾晶体,于是溶液迅速变成黑棕色,指示着已经发生了化学反应。
发生了什么呢?以图E04覆盖E03来讨论这个问题,说明分解和氧化还原反应。
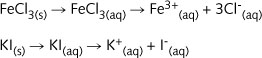
三碘化铁和氯化钾在水中都完全溶解时,并不会产生沉淀。然而,能显示出生成了亚铁离子和碘单质, 观察到的棕色就是由碘单质造成的。在下面的氧化还原反应中Fe3+
氧化I-:
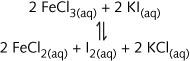
或者只写出在溶液中参加反应的 “实质”粒子:
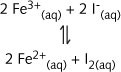
图E03指出,如果氯化亚铁和碘单质溶解在水中,它们就会形成平衡,而平衡体系中包含反应物和产物,尽管它们的浓度不同会导致颜色的不同。
即使混合的量符合化学计量关系,浓度和溶液颜色可能也会有所不同。
此外,由于碘离子的存在碘单质在水中的溶解性加强了,因为形成了更易溶的I3-,它在水中呈棕色。