E14 水中的酸碱平衡:强碱和弱碱
|
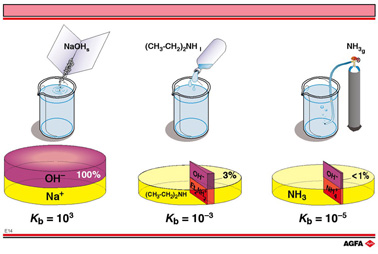
目标:比较 1mol/L 强碱、中强碱和弱碱水溶液的解离度。 |
我们的食物中酸性物质比碱性物质多。而另一方面,我们的清洗产品碱性物质占多数。
与六大强酸不同,强碱都是离子化合物,室温下都是固体。我们最熟悉的碱是 NaOH 和 KOH。就像大多数碱金属和铵化合物一样,强碱很易溶于水。在解离过程(见 DIDAC-1)中,离子从晶体表面脱落均匀分布在水溶液中。可能是因为与晶体相比,水中的库仑吸引力少的多。
如此强的碱性是因为它们的碱性或去质子性质而得到了氢氧根离子
OH-水中解离过程:
![]()
离子能与水分子进行质子交换反应:
![]()
这种持续的质子交换没有实际作用。因此可以说氢氧根离子在水中稳定存在。
水溶液中OH-离子浓度大于10-7mol/L被称为碱溶液。去掉碱溶液中的氢氧根离子有很多方法。众所周知最常用的方法是用氢离子中和:
![]()
![]()
这再一次说明了溶解度和离解度之间没有关系。室温下氨在水中是弱碱,平衡常数为1.8 x 10-5.
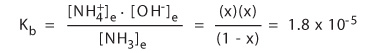
解方程式,1mol/L的氨水溶液产生的氢氧根离子浓度为4 x 10-4mol/L。这就是一些清洗剂中氨的浓度。这个例子中解离度是0.0004或者离解分数是0.04%。
图例E14中列举了三种不同碱的解离分数,每一个都对应不同的Kc值。对于碱,经常用Kb代替Kc(而酸用Ka)。
下列碱的Kb值:
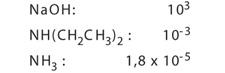
碱的饼状图与酸的类似:紫色部分表示生成OH- 的那部分,红色部分表示形成或解离后的阳离子,黄色部分表示溶解的但并未解离的分子。
二乙基胺是不常见的弱碱,1mol/L碱溶液的解离分数为3.1%。
一般而言,在水中弱碱的行为与弱酸很相似,除非在极稀的水溶液中解离度都非常低。