E13 水中的酸碱平衡:强酸和弱酸
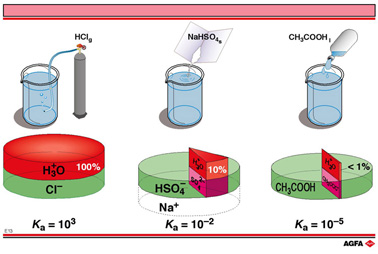
目标:比较1mol/L的强酸、中强酸和弱酸水溶液的解离度,分析酸的Ka与其浓度和解离度的关系。 |
至今为止考虑的均相平衡反应主要都是在气相中的。实际上,大多数反应(平衡反应和非平衡反应) 主要发生在水中。在密闭体系中,如果出现的所有成分都能完全溶解(就是说均匀地分布在所有液相中), 那么这些就是均相反应。
大多数情况下,试管、烧杯和反应容器对空气来说是开放的,但是水的蒸发作用相当慢。然而,当有 气体等易挥发成分存在,尤其是不易溶于水的物质存在时,“开放”体系不能被看做是密闭体系。
在 DIDAC-1 中图H1到H7对这个专题进行了介绍,包括水在不同过程中的作用,例如分子或离子的溶解过程、质子化过程或去质子化过程,这些参与反应的成分表现为碱或酸。
酸碱行为一个非常重要的方面就是在水溶液中H3O+ 或OH-会在或大或小的范围内被发现。许多化学特性都依赖于这些离子的存在。通常较低浓度的这些离子用pH和pOH表示,其中pH =-log [H3O+]e ,pOH=-log [OH-]e。这就避免了使用指数。
在纯水中,H3O+和OH-的浓度非常小,即10-7。这些小浓度的离子来源于水的解离。
平衡反应如下:
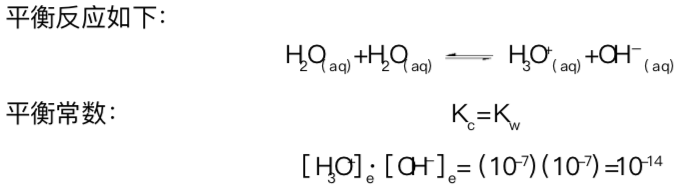
对酸平衡用符号Ka表示平衡常数,而不是Kc。国际上规定,水的浓度[H2O]e不包含在Ka表达式中。通常情况下,Ka是在25 °C测定的。
在下面的例子中,不考虑水的解离。酸和碱解离也产生H3O+和OH-,水解离的部分可以忽略不计。
事实上所有的酸都易溶于水,它们形成均相溶液。氯化氢气体非常易溶于水(大于12 mol/L),其水溶液被称为盐酸。所有溶于水的 HCl 分子,都解离成H3O+ 和 Cl -。这与向水中加HNO3等液体的过程完全相似。在DIDAC-1图H2中描述了这个过程。如果解离在水中发生的话,在任何条件下HCl、HBr、HI、 HClO4, HNO3和H2SO4 (至少第一步去质子)等酸都进行完全去质子反应或解离。这样的反应不是平衡反应。多数其他的稳定酸必须归到弱酸类。
图E13中展示了强酸HCl以及两种弱酸![]() 和CH3COOH解离分数的很大不同。所有溶液的浓度均为1mol/L。
和CH3COOH解离分数的很大不同。所有溶液的浓度均为1mol/L。![]() 是一种酸性阴离子,由白色粉末NaHSO4溶解于水中制得。
是一种酸性阴离子,由白色粉末NaHSO4溶解于水中制得。
这些酸的Ka值:HCl是103,![]() 是1.2 x 10-2,CH3COOH是1.8 x 10-5。
是1.2 x 10-2,CH3COOH是1.8 x 10-5。
饼状图表示了水中解离分子的平衡百分比:
=> 绿色部分代表未解离的酸分子
=>红色部分代表生成的那部分H3O+-
=> 紫色部分代表酸根离子
在饼状图中由NaHSO4产生的Na+用无色表示,因为它们对酸碱性质没有影响。也没有明确指出水。当一种酸完全解离,100份酸产生100份的氢离子(H3O+)和相应的100份阴离子。
在每个饼状图下面给出了相应的平衡反应和能计算平衡浓度的等式。
下例说明了硫酸氢根离子![]() 的解离。恰当的平衡反应是:
的解离。恰当的平衡反应是:
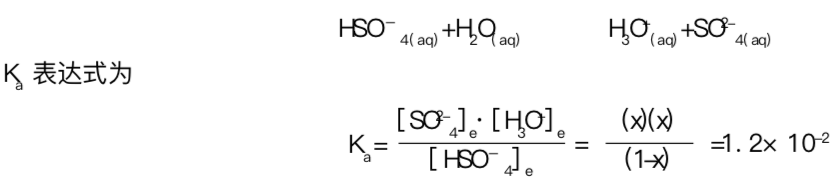
可以用来求 x 值。
从例子可以看出,对于乙酸这样的弱酸来说,解离的程度是很低的。在浓度为1 mol/L的溶液中,解离度是0.0042或者0.42%。食醋中乙酸的浓度是1.3mol/L,解离度是0.0037,[H3O+]e 平衡浓度是0.0048 mol/L。
.对于1 mol/L的![]() 溶液,解离度是10.4%。弱酸有这样的K值(大约10-2)是不常见的。实际上,大多数酸是性质类似乙酸的弱酸。食物和我们的新陈代谢存在着很多这样的酸。即使是很弱的酸,在极稀的水溶液中都能达到解离度为1。
溶液,解离度是10.4%。弱酸有这样的K值(大约10-2)是不常见的。实际上,大多数酸是性质类似乙酸的弱酸。食物和我们的新陈代谢存在着很多这样的酸。即使是很弱的酸,在极稀的水溶液中都能达到解离度为1。