E01 熟悉化学平衡反应:一个实验
目标:展示如何制备 NO2
和 N2O4
, |
平衡这个概念最好是用一个实际过程来描述。二氧化氮的二聚过程能显著说明问题,当红棕色的二氧化氮气体二聚成无色的四氧化二氮时,伴随着可以观察的颜色变化,从红棕色到无色。
二聚是指两个相同的分子键合起来。在这个例子中,两个NO2分子上的未成对电子形成一个键而形成一个N2O4分子,从而没有了未成对电子。
![]()
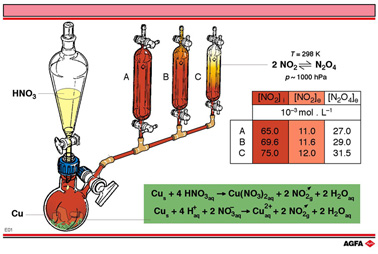
这个反应最好在适当的安全措施(例如,在通风橱里进行)下演示给学生。如果不能演示,可以用图 示来说明过程,正如上图所示。
10g螺旋的铜丝伸入一个带有分液漏斗和出口有活塞的圆底烧瓶。将100 mL浓硝酸倒入分液漏斗,并且缓慢将浓硝酸滴向铜丝,会发生剧烈反应并生成红棕色的 NO2气体(密度比空气大),先将烧瓶,然后将集气容器A、B和C中的大部分空气赶出去,并占据其空间。
加入越来越多的浓硝酸将产生越来越多的 NO2气体,最终将容器A、B和C一个个充满。当每个容器被充满时,尽可能同步并迅速地把这个容器的旋塞关掉。当这个进程结束后,可以假设三个容器的温度都大约相同,是25 °C.
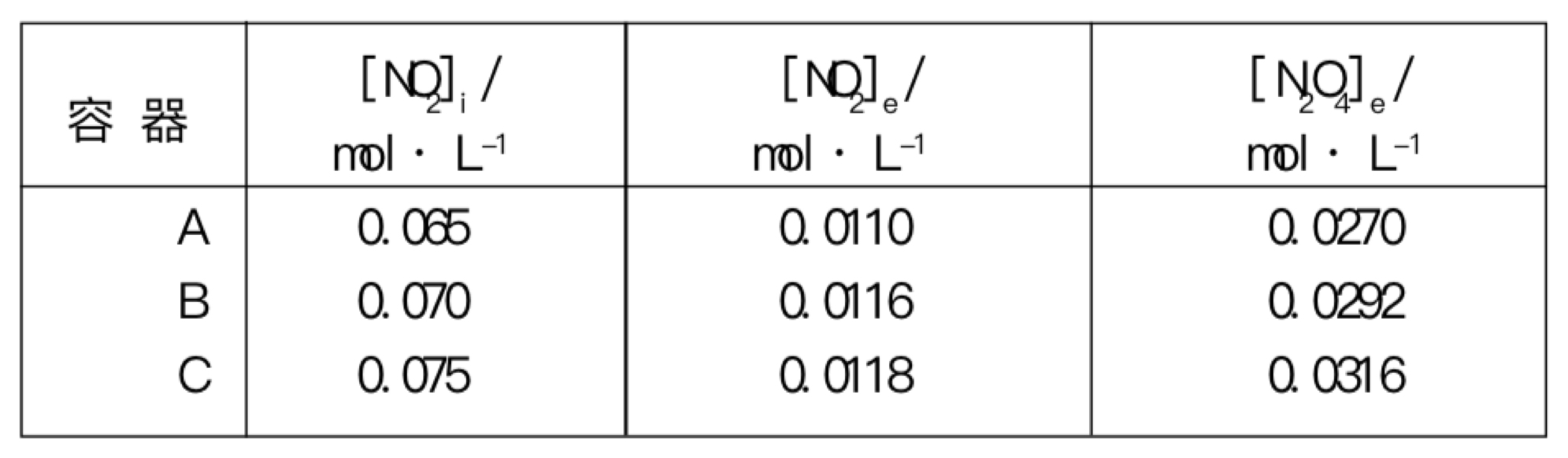
容器A、B、C中最初NO2 的量([NO2]i),平衡时NO2[NO2]e)和平衡时N2O4([N2O4]e)都在右上的表中给出,这些浓度是结合分光光度分析测量法定量测定的。
可观察到如下现象:
ð
ð
ð
ð
下面给出了这些过程的反应方程式(s 表示固体,aq表示水溶液):
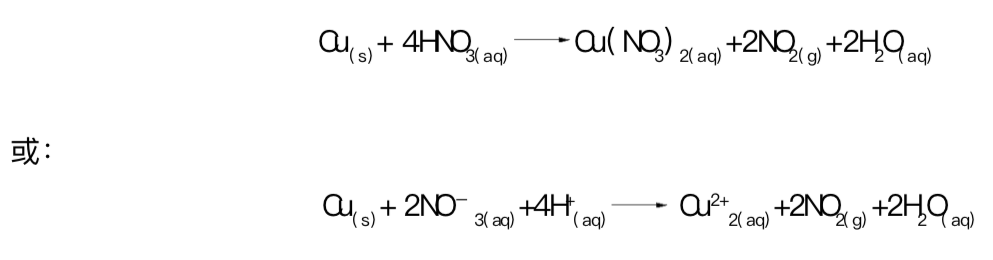
关于NO2气体的注解:
大气中的氮氧化物主要来源于供暖装置和内燃机中化石染料的燃烧。它们是形成众所周知的对湖泊和森林生态有破坏作用的酸雨的要素之一。它们对人类也有毒害作用,吸入会引起呼吸困难,通常刺激呼吸道特别是肺部。来自特殊气象环境的烟雾含有很高浓度的臭氧、硫的氧化物和氮的氧化物。氮的氧化物中毒害作用和刺激性最强的是二氧化氮,但在通常情况下,它会迅速二聚为四氧化二氮。此外,因为会与水反应生成硝酸,还有受紫外线照射分解为 NO 和 O2,没有二聚化的NO2 在空气中最多平均保留 3 天。
然而天气炎热时, NO2 转化成N2O4的反应进行得不完全(见图 E12 的解释),导致严重的环境问题,例如天色昏暗,刺激呼吸道引发哮喘及中毒。
因此NO2 的安全标签包含以下警告:
ð
ð
ð
ð
ð
ð