BP11 丝绸纤维和蜘蛛网
|
目标:说明丝绸和蜘蛛网的分子结构决定他们的强度和弹性。 |
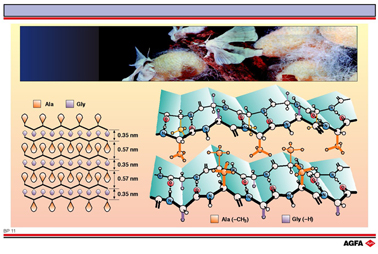
由蚕(上面的图片)或蜘蛛纺成的纤维充分利用了β-折叠这种三维结构。这种重复的β-折叠结构域是由重复的氨基酸链组成的。
[Gly-Ala-Gly-Ala-Gly-Ser-Gly-Ala-Ala-Gly-(Ser-Gly-Ala- Gly-Ala-Gly)8]
右图展示了两个β-折叠堆积的情况。丙氨酸残基中的甲基侧链(橙色)刚好填充在相 邻折叠的甲基空隙内。甘氨酸中的氢原子也以类似的方式与下一层相连。
左图展示了这种堆积的最终结果。相邻层之间的距离取决于侧链的大小:对于甘氨酸的较小的侧链基团(- H)是 0.35nm,而对于丙氨酸类较大的侧链基团(- CH3)是 0.57nm。
蚕丝蛋白并不完全以β-折叠形式存在。有少部分带有较大侧链且体积很大的氨基酸,例如缬氨酸和酪氨酸,它们不能填充进空隙中。在两个β-折叠结构之间,可以发现紧密排列的氨基酸结构域。这些区域使得丝绸纤维具有延展性。不同的桑蚕将产生具有不同氨基酸组成的丝心蛋白。因此纤维的弹性是不同的。