CB01a 化学键是粒子相互碰撞的结果
目标:阐明化学键源于粒子间的相互碰撞,在这个过程中,吸引力和排斥力达到平衡。 |
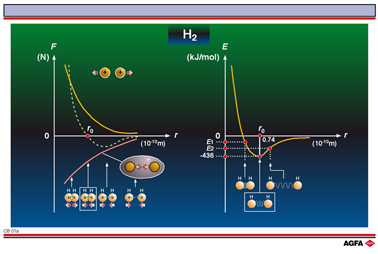
化学键的形成依赖于带电微粒之间的作用力。在幻灯片中,展示了两个氢原子之间的分子间作用力。
这种分子间作用力由两部分构成:两个质子之间和两个电子之间的排斥力,一个原子的质子与另一个原子的电子之间的吸引力。当两个原子相距非常远时,它们之间的影响可以忽略不计,而且两个核电荷之 间的排斥力也可以忽略。然而当两个原子相互接近时,带正电的原子核(质子)也相互接近,由于同种电荷相互排斥,因此原子核之间显示了很强的排斥作用。排斥力的大小与距离的平方成正比。对于一个很小的距离而言,由于电子云的相互叠加会产生额外的排斥力,因此总的排斥力(图中的黄色曲线)会非常大。
随着原子的接近,第二种力也将发挥作用。一个原子的电子云被另一个原子的核电荷吸引得越来越紧 (异种电荷互相吸引)。在两个原子核之间堆积的电子云越来越多。通过这种方式,两个粒子相互吸引(图中的红线)。
一般认为这两种作用力是相反的,其中排斥力用正值表示,吸引力用负值表示。
当两种作用力相反而又大小相等时,两原子之间的距离称为键长(r0)。如果原子进一步靠近,排斥力占主导,粒子相互排斥。然后吸引力再发挥作用,使得粒子回复到平衡位置。可以把这个现象比做弹簧上挂着的重物。不管弹簧是否被伸长或压缩,它总是回复到静止时的位置。
在平衡位置处,粒子的势能最小。这一点表示在第二张图中。
当相距无穷远时,两个粒子的势能被定义为0。随着它们相互靠近,势能会减小直到最小值。当两个粒子相距0.74 x 10-10 m时,势能达到最小。这一长度就是由两个氢原子构成的分子(氢分子)的键长。
为了破坏一个键,需要一定的能量(键能)来使粒子分离。氢分子的键能是–436 kJ mol-1,这意味着要使1 mol氢分子解离成为2 mol氢原子,需要436kJ的能量。