CB03 电负性差异与成键类型之间的关系
|
目标:阐明分子中原子的电负性强烈影响着所生成的键的类型。 |
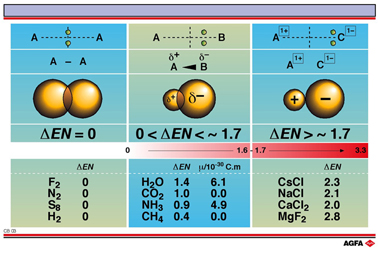
原子的电负性是表达它与其他原子成键时吸引电子能力的数值。对于不同的元素而言,有几种不同的电负性衡量标准,它们只有很小的数值差别。电负性的值在0.3(钫,电负性最低的元素) ~ 4.0 (氟,电负性最高的元素)的范围内变化。在很大程度上,两种原子之间电负性的差别决定了键的类型。
 EN = 0
EN = 0
两种原子具有相同的电负性。谁也不给另一方提供电子。在这两个原子之间会形成共价键。成键电子对(s)对称地分布在两个原子核之间。
 EN < ~ 1.7
EN < ~ 1.7
两个原子之间的电负性差别依然很小,但是其中一个原子吸引电子对能力强于另一个。这就形成了极性键。电负性较大的原子带有部分负电荷(d-),而另一个原子带有部分正电荷(d+)。
 EN = > 1.7
EN = > 1.7
两个原子的电负性差别很大。具有较大电负性的原子从另一个原子那里吸引电子。同时形成正离子和负离子。
很显然,这种分界线很武断。极性共价键到离子键没有突变。电负性的差别越大,两个原子越容易形成离子键。
总体而言,金属比非金属具有较小的电负性。在形成化学键时,非金属显示了较大的获得电子的趋势。在碱金属(Li,Na,K,Rb,Cs)和卤素(F,Fl,Br,I)形成的化合物中具有最强的离子键。
注意
由含有明显的极性键的分子,例如水(H2O)、氨(NH3)、二氧化碳(CO2)、甲烷(CH4), 等构成的 物质不一定具有极性。这可能由于分子中不同极性键相互抵消了,或者相互“中和”了。必须考虑由极性 键产生的偶极矩的方向和电荷,因为它们产生了整个分子的偶极矩。CO2, 是由两个 C 和 O 原子之间的极性键形成的非极性分子,每个极性键具有方向相反的偶极矩。
H2O 和 NH3 是极性分子,CH4 是非极性分子。然而所有这些化合物都含有极性化学键。