CB02 通过不同方式形成化合物
目标:阐明三种基本的化学键类型。 |
原子趋向于达到一种稳定的状态——稀有气体结构。
原子如何达到这种状态主要取决于它们的价电子(原子外层处于高能量状态的电子)和邻近的原子。
我们可以将其分为三种情况:
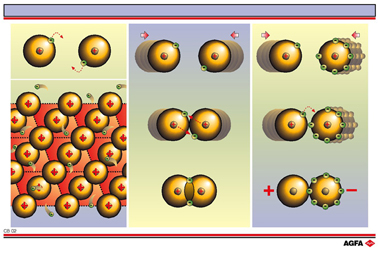
金属键
每个金属原子只有少量的价电子。这些价电子相对松散地结合在一起。原子可以通过失去这些电子来达到稀有气体的结构,此时将产生带正电的金属离子(金属晶格)。被释放的电子在金属晶格中自由移动(自由电子)。自由电子的负电荷将与带正电的金属离子结合在一起。
每个原子都趋向达到稀有气体的结构。在原子键(共价键)中,两个原子核通过共享一些电子来达到 稀有气体结构。当两个原子的电负性相差不大(见插图CB03),且原子仅比稀有气体结构缺失少量电子时, 通常就会形成这种类型的化学键。
插图 CB01b 说明了电子是怎样被共享的。
术语解释
- 原子键:两个中性原子之间形成的键。它不同于金属键(离子和电子之间的键)和下面这种化学键:离子键。
- 离子键:它是两个带电荷的离子之间形成的键。
- 共价键:来自拉丁文“cum valere”:等数目,等价。
离子键
当两个原子的电负性差别很大,那么一个原子将接受另一个原子的价电子,从而产生正离子和负离子。 由于异种电荷互相吸引,因此这两种离子相互键合。
给予电子的原子在其最外层上仅含少量的电子,通常在次外层上含有8个电子。因此,该原子失去其的价电子并达到稀有气体的结构。这是核外电子的一种非常稳定的排布状态,也是稀有气体反应活性低的原因。
相对于稀有气体结构而言,接受电子的原子缺失了一些电子,但是它可以通过获得其他原子的电子来达到稀有气体结构。