CB08 晶格结构
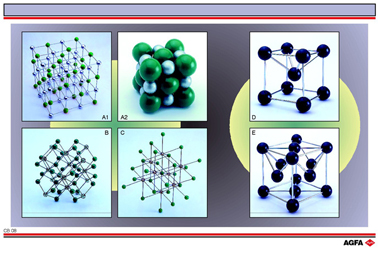
|
目标:举几个离子化合物和金属的晶格结构的例子。 |
原子、离子和共价分子可以排列在几乎有序的三维晶格构成的固相中。这些晶格决定了固体的外观和性质。我们可以区分三种主要的晶格类型:
分子晶格
在分子晶格里,共价分子仍然是可相互区分的独立的个体。例如在冰的结构中,单个水分子仍是可以区分的。
离子晶格
在离子晶格中,带异种电荷的离子相互吸引。这种吸 引存在于各个方向上。这就是为什么我们不能区分这种三维晶格里的单个的分子的原因。在插图中显示了以下列化合物的结构:
NaCl (氯化钠,插图中的A1和A2)
CaF2 (氟化钙,插图中的B)
CsCl (氯化铯,插图中的C).
金属晶格
金属晶格由带正电的金属离子和在它周围自由移动的电子构成。插图中给出了铁(右上,D)和铜(右 下,E)的示意图。在金属晶格中,金属原子并不是任意的堆积在彼此上方,而是占据了确定的空间位置。 这种排列就是所谓的“晶胞”,它不断地在晶格中重复排列。
铁具有体心立方的晶胞,在立方体中,铁原子占据8个顶点和体心的位置。位于布鲁塞尔市的“原子 塔”(为一旅游景点)展示了这种结构。
铜原子也构成一个立方体,不过这个晶胞是一个面心立方体。这就是说铜原子不仅占据立方体的8个 顶角,而且占据立方体的每个面的中心。
密堆积
如果我们假设原子和离子是近似球形的,而且它们在晶格中相互排列得尽可能紧密,那么就形成了密堆积结构。用密堆积表示晶格接近真实情况,但不是很清晰。为了说明离子和原子的排列情况,通常需要把晶格模型一层层地分开。在插图中,分别以开放的结构(A1)和密堆积的结构(A2)表示了氯化钠的结构。