CB09 碳,具有多种同素异形体的物质:金刚石,石墨和富勒烯
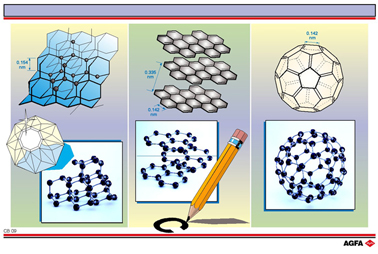
目标:说明三种不同的碳的同素异形体,并说明由于取向和杂化的不同,同种原子可以具有不同的性质。 |
在金刚石(上图左)中,每个碳原子以sp3杂化轨道与其他4个碳原 子成键,构成一个四面体结构。
每个碳原子中的四个价电子都配对填在成键轨道中。因此金刚石 很稳定,是具有高熔点的绝缘体和世界上最坚硬的物质。
金刚石是透明的,具有高的折射系数。与之相反,石墨(上图中) 是一种柔软的黑色材料。石墨是由碳原子组成的六元环层状结构构成 的。层与层之间由相对弱的色散力
(伦敦力)结合在一起(见 CB13 和 CB15)。
层之间可以很容易的滑动。石墨的应用之一就是作为润滑剂。
石墨里的每个碳原子通过sp2杂化轨道与其他三个碳原子成键。这一结构可以用共振杂化来表示,其中每个键均具有4/3的部分双键性质。
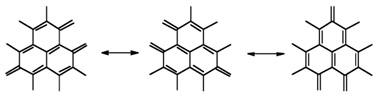
每个碳原子贡献3个价电子给这3个σ键。第四个电子与相邻的原子形成了p键。这并不是一个定域键,电子可以在整个p键体系中自由移动。平行于层的电子传导率是高的,但垂直于层的则是低的。
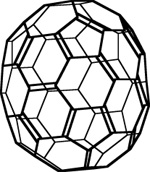
最近还合成了其他的富勒烯,包括嵌入金属的富勒烯。
其他富勒烯的例子:
C70, 轻微伸长的C60.
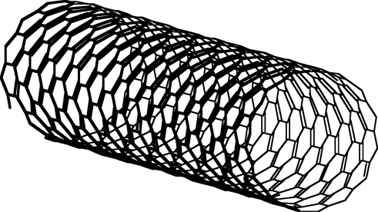
纳米管: