CB19 σ键(σ分子轨道)
目标:● 说明分子轨道是怎样由原子轨道的组合形成的。● 说明s轨道和p轨道结合时形成不同的重叠方式。● 说明分子重叠的特性和键长之间的关系。 |
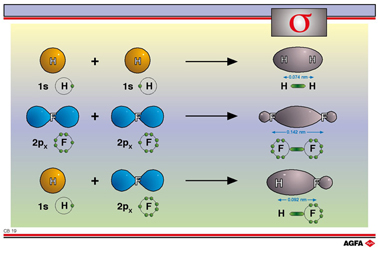
轨道是波函数(见 DIDAC-3的原子模型部分)。化学键可以用波函数的和来表示。氢原子的两个1s原子轨道组合后会形成氢气分子中的两个新的分子轨道:成键分子轨道和反键分子轨道。
p轨道有两种可能的重叠:沿轴向重叠或垂直轴向重叠。p轨道的轴向重叠也被称为σ键合。图中说明了F2 分子:2px原子轨道的轴向重叠形成了一个σ键。注意在原子核处有节点。在这里发现电子的概率为0。
两个s原子轨道的重叠可形成比两个p轨道重叠更强的键。这是因为s电子比p电子离核更近,使得核结合得更紧密。这就使得H2的键长比F2的短。
一个s轨道和一个p轨道重叠的效率介于前面两者之间。HF的键长介于H2和F2的键长之间。在HF中,由H的1s轨道和F的2px轨道形成了σ键。在成键分子轨道中,在F的原子核上有一个节点。