CB20 π键(π分子轨道)
|
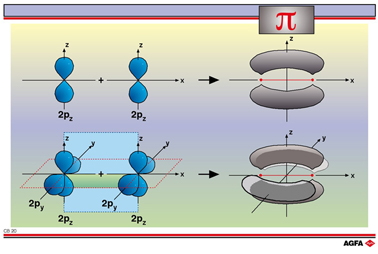
目标:说明σ键和π键之间的空间差异。 |
只有当两个原子已经通过一个σ键结合时,才能形成π键。π键比σ键弱,因为p轨道的侧面重叠效果要差一些。因此一个双键的强度比一个单键强度要大,但比该单键的两倍要弱。
如果原子有充满电子的py轨道,那么沿着y轴可以形成第二个重叠,并形成第二个π键。这可用三键表示。
C – C 单键
0.154 (键长0.154 nm)
C = C 双键 0.134 (键长0.134 nm)
C º C 三键 0.120 (键长 0.120 nm)