ST07
液-液混合物(溶液)的分离
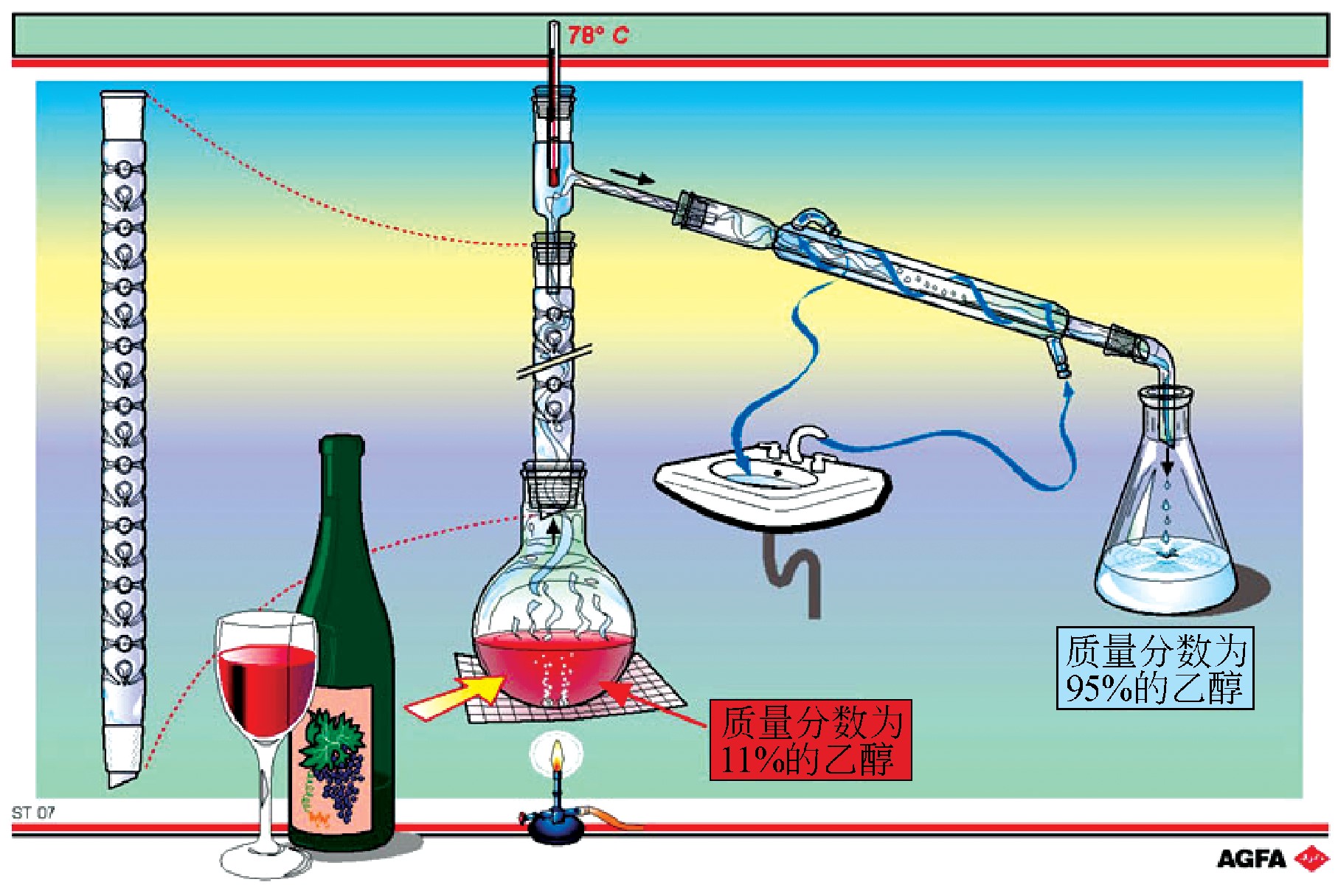
| 目标:展示分离液-液混合物的分馏法的运用。在该方法中,混合物组分的沸点相似。 |
要通过蒸馏法进行完全的分离,冷凝的蒸气首先必须只含有沸点最低的组分(混合物中更易挥发的组分)的微粒(分子)。要满足这个条件,待分离的两个组分的沸点必须相差较大。经验表明,对于一般的蒸馏过程,组分的沸点至少必须相差25℃。即使该条件满足了,蒸馏物中还是会含有不易挥发的组分的微粒(分子),分离永远不完全。
在实际中运用的方法是分馏,这种技术能取得较好的分离效果,可以分离组分沸点相差在25℃以内的液体混合物。但是,这种技术同样也不能取得绝对完美的分离结果。
在蒸馏烧瓶和李比希冷凝器之间放一个精馏柱,就可以进行这种更有效的分离过程。精馏柱是一根填充了玻璃珠或玻璃棒的管子,或者是内侧管壁上有许多内凹的锯齿状缺口的管子(如图)。柱的上端温度较低,混合蒸气在那里冷凝。上升的蒸气必须通过往下滴的蒸馏物才能到达冷凝器。正是因为上升的蒸气和下滴的蒸馏物的紧密接触,低沸点组分的微粒(分子)才能上升到柱子上端。结果,越往柱子上端,挥发性最大的组分的蒸气越浓。
理论背景:
如果组成混合物的挥发组分符合拉乌尔定律:
P溶液=X溶剂 P0 溶剂
这里:
P
X溶剂 指溶剂的摩尔分数;
P0 溶剂 指纯溶剂的蒸气压。
那么混合物上方的总蒸气压可以表示为:
P总 = X1P01 + X2P02
每一组分对蒸气压的贡献和该组分的摩尔分数乘以其作为纯溶剂时的蒸气压P0成正比。这条定律对理想混合物是适用的,因此理想混合物可以通过蒸馏有效地分离。分离效率随着组分沸点差的增大而提高。
下面的图展示的是遵循拉乌尔定律的二组分混合物的组成变化。y轴给出了纯组分的沸点 (T1和 T2).
这两点由两条曲线相连接,分别表示液体混合物的组成变化(下方的曲线)和蒸气混合物的组成变化(上方的曲线)。x轴代表混合物的组成。
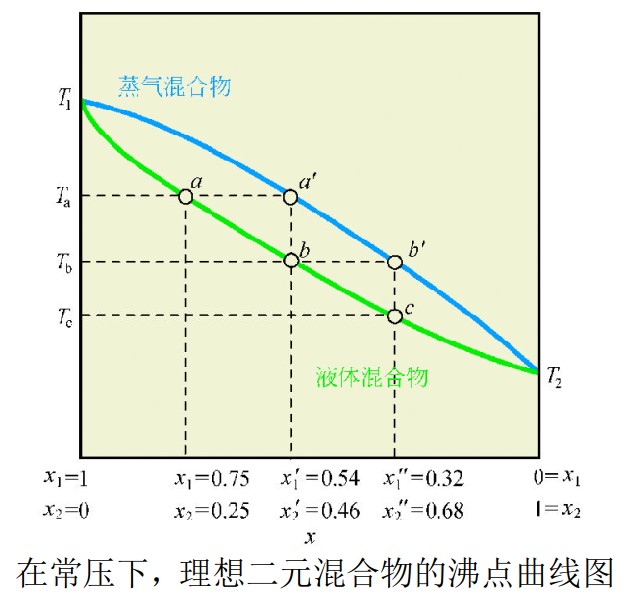
组分1的摩尔分数等于0.75 (X1
= 0.75) 、组分2的摩尔分数等于0.25 (X2 = 0.25) 的混合物在温度 Ta沸腾。 方的曲线表示液相的组成。对于我们讨论的混合物来说,曲线上的a点代表了这一点。与之对应的气相的组成是a’,两组分的摩尔分数分别是 X1’ = 0.54 以及
X2’ = 0.46 。这里我们可以看到,在气相中,易挥发组分2的摩尔分数提高了。
如果含有该组成的蒸气被冷凝,那么得到的混合物中就含有了更多的易挥发组分。这代表了蒸馏过程中的一步。与组成为b的液相相平衡的气相具有组成b’,各组分的摩尔分数为 X1’’= 0.32 和 X2’’
= 0.68。冷却得到的液相组成为c。这就是第二步蒸馏。结果,在每一步蒸馏中,易挥发组分(组分2)的摩尔分数逐步增加。在分馏中,蒸馏的步数要远远多于一般的蒸馏。
如果混合物不遵循拉乌尔定律,就会有偏差。如果是正偏差,二元混合物的蒸气压要比拉乌尔定律预言的高。在这种情况下,混合物会在较低的温度下沸腾。
另一方面,如果是负偏差,则蒸气压降低而沸点升高。
对于正偏差,有时混合物的沸点会比易挥发组分的沸点低,在这种情况下,沸点曲线的最低点将代表一个固定的混合物组成。
这个混合物有一个名称,叫正“共沸混合物(恒沸物)”,字面意思是“不能通过沸腾而改变”。这种最低沸点混合物液相的组成和气相的组成完全一样。
这就是说,这时的混合物表现得像纯净物。而且,由于气相组成和液相组成完全一样,这样的混合物不能通过进一步的蒸馏来分离。
下面的图表展示了一个二元混合物的沸点曲线,由于相对拉乌尔定律有正偏差,出现了一个最低沸点。
这种情况的一个例子是水/乙醇混合物,在某一特定的组成下,它具有比纯乙醇沸点(T2 = 78.3 °C) 更低的沸点
(78.2 °C). 这时,水/乙醇混合物含有质量分数为4%的水(体积分数为3%, X1’’’ =
0.09), 质量分数为96%的乙醇 (97%, X2’’’
= 0.91).
相对拉乌尔定律的负偏差则导致二元混合物有一个最高沸点。对这样的混合物,两相的组成再次达到在常压下,理想二元混合物的沸点曲线图 在常压下,不遵循拉乌尔定律,
存在正偏差的非理想二元混合物的沸点曲线图相等,这叫负共沸混合物。一个例子是水/ 20.2%(质量分数)氯化氢,它的沸点是108.6 °C, 比纯水的沸点高
(T1 = 100 °C).
当不同分子的相互作用比相似分子的相互作用强时,相对于拉乌尔定律的负偏差就会增大。混合的过程伴随着放热过程(放热混合物)。
拉乌尔定律的正偏差可能有两个原因:(1)不同分子间的相互作用较弱,并且混合过程是吸热的;(2)
混合物中的分子混乱程度比拉乌尔定律预想的低。这就解释了为什么有些放热混合物(比如乙醇/水体系)
往往表现出正偏差。
在图ST07的例子里,起始点是酒。酒的乙醇含量略高于10%。分馏得到含有96%(质量分数)乙醇和4%(质量分数)水的混合物。要得到100%的乙醇,混合物还要经过干燥剂,如CaCl2 的进一步处理。
