E09 平衡定律的应用:一种成分的浓度变化
|
目标:按照平衡定律说明如何由改变一种成分的浓度来改变平衡混合物。 |
很显然,这样简单一个基本定律会有很多有趣而有益的应用:
- 如果已知一定温度下某反应的平衡常数,我们就能预测(计算)已知反应物浓度的反应的平衡浓度。转化率也能计算出来,但是平衡时间则不能由此计算。
- 如果已知某平衡反应混合物的初始组成和其中一个成分的平衡浓度,那么在此温度下其他成分的平衡浓度和Kc值都可以计算出来。
- 平衡定律可以用于化工反应,利用改变反应物初始浓度来增加不完全反应的产率。
在课本后边还会用更长的篇幅讨论这些应用的可能性。 我们进一步认识到温度的变化将会引起平衡的变化:每一个反应温度对会对应一个不同的平衡常数。因此它的影响应该分开讨论。
除了反应温度外惟一能改变平衡混合物的方法是改变一种成分的浓度或者同时改变所有成分的浓度。
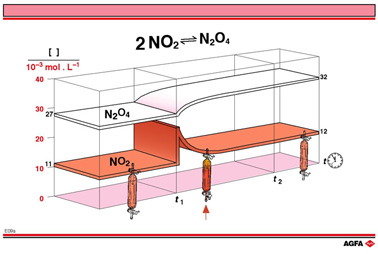
在图 E09 中展示了改变 NO2浓度对NO2二聚反应的影响。反应物NO2,和产物 N2O4 的浓度都是时间的函数。初始情况对应着图 E06 中实验A的平衡状态。
初始NO2和 N2O4平衡浓度分别是0.011 mol/L和0.027 mol/L 。棕色线表示在时间t1因从系统外另加入了NO2使其浓度加倍。
在图 E09a 中,时间t1和达到新平衡的时间t2之间没有平衡状态,NO2和N2O4在反应混合物中的浓度 随着变化最终达到新的平衡浓度。对于NO2和N2O4新平衡浓度分别是0.012 mol/L和0.032 mol/L。
随着一种浓度的改变,在密闭系统中各成分的浓度也发生改变。起初看起来会觉得奇怪:
NO2浓度迅速增倍导致N2O4浓度增长很快(注意:这个特例未必会广泛适用)。
这些不时出现的浓度改变是可以用平衡定律来解释。在图E09b中用反应商Qc来解释这个问题。平衡反应的反应 商Qc相对于Kc的不同之处在于用各成分在某给定时刻实际浓度而不是平衡浓度。
在NO2二聚反应的例子中,Qc 和Kc 的相应表达式是:
![]()
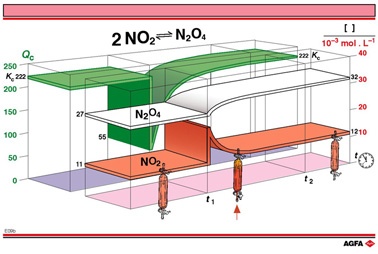
在t1 时,加倍的NO2浓度得到的Qc值大约为55,也就是(0.027)/(0.0022)2。这相当于同温度下该平衡Kc值的四分之一。 因此Qc小于Kc。依据平衡定律,Qc会不断增长至与Kc相等为止,也就是达到 222。这就是 Qc 随时间的变化,在图E09b中用绿色带表示。
为了得到Kc值,分子必须由x增加到 (0.027+x)。分母相应由2x减少到(0.022- 2x),因为每生成一分子N2O4需要消耗2分子NO2。
.
新的平衡浓度用 [ ]’e, 表示,可通过解方程的方法由平衡定律和K 值计算得出:
![]()
下表给出了定量结果,对解释图E09a和 E09b有帮助。
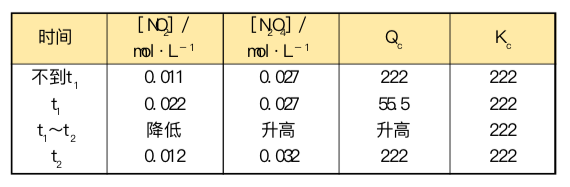
新平衡浓度NO2为0.012 mol/L而N2O4为0.032 mol/L,将其代入Kc表达式得到Kc值是222。
干预的结果可以定性解释如下: “如果平衡混合物中的一种成分的浓度发生改变,系统会自身调整而尽可能地减少这种影响。”
这个有名的规则被称为“勒沙特列(Le Chatelier)原理”或者“最少应力”原理。
注意
化学平衡并不完全不受干扰。例如在相平衡中,尽管体系为抵消NO2浓度的增长从初始的0.022 mol/L 减少到0.012 mol/L,然而这仍然比初始值0.011 mol/L高。干扰引起有趣的结果,尽管转化率减少了,但是平衡却右移了。为了使反应完全,应该在温度保持恒定的情况下使密闭体系反复进行化学平衡反应。在这个例子中,干扰几乎被反应混合物完全抵消,这依赖于相当大的Kc值。在Kc值很小的反应中(例如弱酸),抵消的量就小得多了。