E10 平衡定律的应用:体积变化引起所有成分浓度变化
目标:依据平衡定律,举例说明所有成分浓度 |
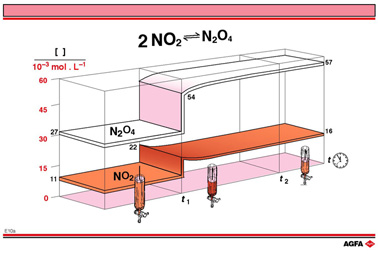
改变密闭体系的体积能使气相平衡移动,所有成分的浓度也因此改变。图例E10a展示了减小密闭体系的体积后NO2和N2O4浓度随时间的变化过程。因为另加入了NO2,起始点就是实验A的平衡混合物。在时间t1反应体积减半,比如通过在汽缸中推入一个活塞。这使NO2和N2O4的浓度加倍(相应浓度分别变为0.022 mol/L和0.054 mol/L),不再符合25°C时的平衡条件。
N2O4和NO2浓度突然加倍被反应混合物的浓度变化抵消,N2O4浓度缓慢地增长到0.057mol/L,NO2浓度缓慢地从0.022mol/ L减少到0.016 mol/L。当然了,这要与反应中2:1的计量系数一致。
N2O4浓度进一步增长的事实(增长到0.057mol/L),提出了一个问题:如何解释这个现象?是反应的计量关系改变了,还是仅仅因为N2O4浓度更大一些? 可用平衡定律来解释。
图 E10b 中绿色带表示 Qc随时间函数的变化。浓度的加倍使 Qc值从222减少到了 111,是Kc值222的一半。遵照平衡定律,干预会被浓度变化抵消,迅速或缓慢地达到由Kc值确定的新值。这些变化必然导致 分子的增大和相应分母的减少,由反应计量系数规定。N2O4的新平衡浓度是0.057mol/L,比体积减少产生的浓度稍高一点。NO2的新平衡浓度是0.016 mol/L ,比体积减少产生的浓度稍低一点。
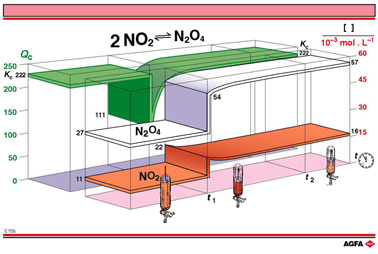
图E09b中的计算和标度对理解Qc随时间变化(绿色带)和N2O4(白色带)及NO2(棕色带) 随时间的变化的关系有帮助的。
如果体积减少后的平衡浓度与之前相比, 两种成分的浓度都增大了,这仅仅是因为体积的减少。对于拥有较小计量系数的N2O4,浓度的变化更大,尽管对于NO2变化已经尽可能被抵消了。这再一次证实了广泛适用的最小变化原则,最终NO2的浓度不可能低于先前的平衡浓度。
总结
在反应物和产物浓度变化同时和一致的情况下,依赖平衡定律能再次预测新平衡混合物的组成。这是 一个简单的经验法则,如果各成分的浓度同步一致地增长,依据勒沙特列原理平衡将会移向反应方程式中 分子数较小的一边,以使单位体积内的分子数尽可能保持不变。另一方面,在各成分浓度同步一致减少的 情况下,平衡将会移向反应方程式中分子数较多的一边,以使单位体积内分子数尽可能保持不变。总的来说,如果体积改变,可以用浓度的变化来预测其影响。