E11 平衡定律的应用:温度变化
目标:说明温度对平衡混合物有什么影响作用。 |
一般说来,一个或者多个组分的浓度改变仅仅对平衡反应有影响。温度的改变与其说带来的是平衡的改变,不如说是带来平衡常数的改变。平衡常数总是随着温度的变化而变化。
记住这一点就够了:“在放热反应中,Kc值随温度的增加而降低;而在吸热反应中,Kc值随温度的增加而增加。”
在范得霍夫方程中,Kc是和绝对温度有关的:
![]()
在方程式中,K1是温度为T1时的平衡常数,K2是温度为T2时的平衡常数,![]() 是标准状况下的摩尔焓变,R是摩尔气体常数8.314 J·mol-1·K-1。
是标准状况下的摩尔焓变,R是摩尔气体常数8.314 J·mol-1·K-1。![]() 在放热反应中为负值,在吸热反应中为正值。而且
在放热反应中为负值,在吸热反应中为正值。而且![]() 与温度没有很密切的联系。考虑到温度对于平衡体系的影响,我们首先要解释平衡定律的发展:首先在第一个平衡时起作用,接着是在最终温度情况下起作用。然后,我们要定性地运用勒沙特列原理重复这一推理过程。
与温度没有很密切的联系。考虑到温度对于平衡体系的影响,我们首先要解释平衡定律的发展:首先在第一个平衡时起作用,接着是在最终温度情况下起作用。然后,我们要定性地运用勒沙特列原理重复这一推理过程。
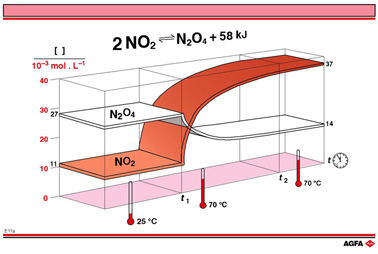
我们用NO2的二聚反应(图 E11a)来研究温度对于平衡反应的影响。再次,我们的起点是从实验 A 得到的混合平衡体系。在一个反应式中,所有增加的摩尔反应热都表示在方程式的左边,所有减少的摩尔反应热都表示在方程式的右边。上图 E11a 表示的NO2的二聚反应的方程式如下:
![]()
“+58 kJ”写在方程式的右边表示这58kJ是在二聚反应的过程中放出的热量,也就是说这个反应是放热反应。
在T1时,从平衡A得到的混合平衡体系,受到温度从 25°C上升到 70°C的影响(比如在加热条件下)。 在这个更高的温度下需要使用新的平衡常数,而由于这是个放热反应,这个新的平衡常数要比25°C的低。
在 E11a 图中,N2O4和NO2的浓度随着温度突跃(开始于时间 t1)的变化在时间轴上表示出来。新的平衡在t2时刻达到,NO2的浓度有显著提高(0.037 mol/L对比0.011 mol/L),而N2O4的浓度有显著降低 (0.014 mol/L对比0.027 mol/L)。
在第一个例子中,浓度曲线的交叉或者NO2浓度增加到超过最初的N2O4的浓度似乎显得很不寻常。
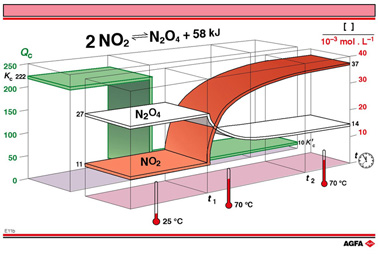
但是,平衡定律已经解释这一现象,可以从图E11b看出来。由于反应温度的升高,温度突越带来了平衡常数Kc的明显下降,从222降到10。由于![]() 已知,这个新的Kc可以由范得霍夫方程算出来,70 °C时的Kc计算值为10.2,而25°C时的计算值为222。
已知,这个新的Kc可以由范得霍夫方程算出来,70 °C时的Kc计算值为10.2,而25°C时的计算值为222。
在很短时间内,温度由25°C升高到70°C,新的Kc值变为10.2,但是25°C的平衡浓度不再满足新的平衡条件:
![]()
在t1到t2的时间间隔中,Qc会从222(与 25°C的Kc相同)降到 10.2(与70°C的Kc 相同)。为了使Qc 减少,根据二聚反应的化学方程式中化学计量关系。分子要减少x而相应的分母要加上2x,x可以从以下 的方程算出,新的平衡条件下浓度用[ ],e表示。
![]()
解方程得x值为-0.049 mol/L,但是根据化学反应的事实要舍弃,否则它会使得平衡中的NO2浓度成为负值。还有一个解为+ 0.013 mol/L,符合反应实际。
根据反应的化学式,NO2的增加量为0.026 mol/L,是N2O4减少量(0.013 mol/L)的2倍,NO2和N2O4的平衡浓度分别为0.037 mol/L和0.014 mol/L。
温度的变化就是这样改变反应平衡,新的NO2平衡浓度比N2O4浓度还要高。
勒沙特列原理也得到相同的结论,升高温度意味着外界热量进入体系内,体系就要试图反作用来减少体系中的热量。换言之,当热量被吸收时反应会加剧,也就是N2O4分解成NO2。
为了方便观察变化,下图给出了不同温度下得NO2二聚反应的Kc值:
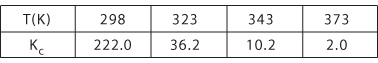
利用这些Kc值,关于温度对于NO2和N2O4平衡的影响能够得到进一步阐释。