E12 化学平衡移动时反应速率的变化
目标:用动力学描述这样的过程——达到新平衡状态时反应速率与原先不同,但正逆反应速率相等。 |
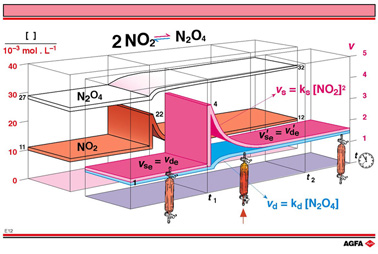
与NO2二聚化合成N2O4相关的反应速率用脚标s表示,与N2O4分解生成NO2相关的反应速率用脚标d表示。
图E12中描述了t1时间向密闭体系加入NO2后,N2O4合成和分解的反应速率随时间的变化。图E09a描述了NO2浓度加倍后NO2和N2O4浓度的变化,而且可作为图E12的参照,会得出达到平衡后N2O4浓度有稍稍地增加,NO2浓度和加倍的数量比减少了相当多。
NO2浓度加倍后,N2O4分解速率vd变化较少。与分解速率相比合成速率暂时较高,保证了消耗NO2生成N2O4。t1到t2时间内,随着合成速率的降低,分解速率缓慢增长。
在t2 时刻,分解和合成速率再一次相等,但这时的速率v’se = v’de, 比原先平衡时的速率vse = vde要大:
![]()
其中ks和kd 分别是合成和分解反应的速率常数。