R3 经典的电化学电池
目标:描述经典的电化学电池,并将它与一个类似的特殊例子作比较。 |
图R02表明,碘离子I-与三价铁离子Fe3+之间的电子转移可用来产生电流,方法是在两份溶液中分别放入铂电极,用导线连接铂电极,并用盐桥连接溶液。构成电子转移反应的两个半反应分别在两个烧杯的溶液中发生。这就是一个电化学电池,发生两个半反应的烧杯就是它的两个半电池。所以,电化学电池是一种装置,它能使电子转移反应按这种方式发生,并在两个电极间产生电流。
如果把金属锌片放入蓝色的硫酸铜(CuSO4)溶液中,溶液的颜色自动变浅,锌片也会变成红棕色。锌金属与二价铜离子之间发生了电子转移,随之铜沉积在锌片上。随着铜离子不断地在锌片上被还原为铜, 溶液颜色会不断变浅。而金属锌则被氧化成无色的锌离子。这个反应可表示为:
原则上,因为电能可转化为热能,电子转移反应可由温度升高间接观察到。
该氧化还原反应可拆分为以下两个半反应方程式:
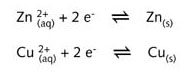
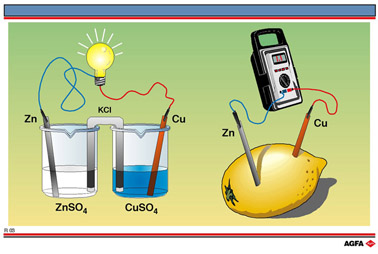
如果这两个半反应如R02(右边)所示分别在两个烧杯里进行,每个烧杯中都有金属作为电极浸在相 应金属盐的水溶液中,用盐桥连接两份溶液,两个电极用导线连接在灯泡上,如R03图示,我们就再次做成了可产生电流的电源。
该装置又一次证实反应涉及电子转移。如果这个简单电化学电池的温度保持在25°C(298K),而且锌离子与铜离子的浓度都是1 mol/L,我们就得到了丹尼尔(Daniell)电池。
一个电池中,电子流过外电路的趋势用电动势来定量度量,也称为电池电势Ecell。电池的电动势可用高阻抗伏特计测量,它消耗的电池电流可忽略不计。丹尼尔电池的电势为+1.1 V。
习惯上,电池电势的方向取从电池左边到电池右边,将负电极(或相对负的电极)放在电池左边。所以有:
![]()
电池可表示为:
![]()
虽然硝酸盐、氯化物或硫酸氢盐也可以应用在电化学电池中,但是实践中经常使用硫酸盐。
如 R02 所示,盐桥中含有KCl或KNO3。这是一个十分有效的离子导体,可以很好地连接溶液。它不含任何可能起干扰作用的物质。
两个电极一经连接,电流开始流动,反应开始进行。当电子在锌电极和铜电极之间流动时,一个半电池中的锌离子浓度不断上升,而另一个半电池中的铜离子(II)浓度不断下降,造成离子不平衡。
这个结果使得两个半电池之间的电势差减小。两份溶液间的盐桥可以维持离子平衡,不会使一个半电池中的离子移到另一个半电池中。盐桥中的正离子(阳离子)扩散进硫酸铜溶液中,负离子(阴离子)扩散进锌离子溶液中。反应一直持续进行到两个电极间的电势差最终降为零。此时,所有铜离子或金属锌电极材料全部消耗殆尽。
图R03右边有一个柠檬,上面插有两个电极,一个是锌,一个是铜。若用导线把两个电极连接在伏特计上,可以测量到电势差(明显小于1.1 V)。同样,锌是阳极,铜是阴极。
柠檬中肯定含有离子,起到与丹尼尔电池中Cu2+和 Zn2+一样的作用。即使两个电极插在同一溶液中, 并没有盐桥,离子扩散仍然很慢,所以电压很低,但还能测得出。
柠檬中肯定含有离子,起到与丹尼尔电池中Cu2+和Zn2+一样的作用。即使两个电极插在同一溶液中,并没有盐桥,离子扩散仍然很慢,所以电压很低,但还能测得出。
电池的电极
金属由阳离子(带正电的离子)和周围的电子所组成。当把一条金属放入到这种金属离子的溶液中时, 金属中的一些阳离子可能会溶出,导致金属上电子积累:
![]()
金属条因此带上负电。
反过来,溶液中的金属离子也会从金属条上夺取电子,也会像金属原子那样释放出电荷:
![]()
金属条与溶液之间的电势差取决于金属的性质,以及金属表面上的平衡所涉及离子的浓度。例如,如果我们比较锌(Zn)与铜(Cu),因为锌溶解为离子的倾向更大,沉积为金属的倾向更小,为了在各自的.溶液中达到同样的离子浓度,锌就需要比铜更负的电势。所以,在图 R03 所示的体系中,锌电极为阳极,而铜电极为阴极。阳极上发生氧化反应:锌转变成锌离子。阴极上发生还原反应:二价铜离子被还原为铜金属。在原电池中,阳极用符号s表示,阴极用r表示。在电解池(见R11)中,阳极上发生氧化反应,用 正r表示,阴极用负s表示。对原电池来说,依据阳极和阴极,电压或电池电势可写为:
![]()