R04
电负性表.
|
目标:描述氧化还原反应时,尤其是确定氧化数时,关注元素的电负性。 |
目标:描描述氧化还原反应时,尤其是确定氧化数时,关注元素的电负性。以上提到的例子都是金属与同种金属离子之间发生电子转移的过程。在这些例子中,电子发生了完 全转移。但是,其他大量的电子转 移反应涉及不带电荷的共价分子或多原子离子。例如,共价分子甲烷与共价分子氧气在燃气炉中发生的反应,这个反应的产物CO2和H2O也属于共价化合物。这种燃烧反应本质上可以归为原子间的电荷转移反应。让这两种元素在原电池(在 这里属于燃料电池)中慢慢地反应,很容易就证明了原子间发生了电子转移。这个电池真正实现的是由化学变化(化学能)产生电流(电能)。
![]()
氧化数
为了能用电子转移来描述这类反应,我们必须遵守分配规则。只有这样,化学家才能对化学转换中的电子得失平衡达成一致。这个分配规则的基础就是所谓氧化数,是对特定粒子(离子和分子)中特定原子的一种人为规定:
特定粒子中,某单个原子的氧化数(O.N.)为这个原子实际携带的电子电荷数。例如,离子键中,一个离子实际携带的电荷数为该原子的氧化数,或者将所有共价键当作离子键,指定某原子实际携带的电荷数,得到该原子的氧化数。
确定一个分子结构式中原子的氧化数要考虑所有的价电子,以如下规则为依据:一条共价键中的所有成键电子完全属于电负性大(见R04)的一方。如果构成共价键的元素的电负性相等,成键电子平均分配。分配给原子的电子电荷数(不是以库仑为单位,而是电子电荷为单位)等于该原子的族数与其价电子数之差。由于“原子的氧化数”实际上并不是真实地等于离子电荷数,所以它用罗马数字(而不是用阿拉伯数 字)表示,在罗马数字前面加上正负号(不像电荷符号那样,正负号放在后面)。谈及某元素(在离子或分子中)的氧化数,大家可能会说+II(正二)而不是2+(二正)。这意味着,氧化数与离子电荷的区别不仅容易书面辨认,而且可以听得出来。
例如:

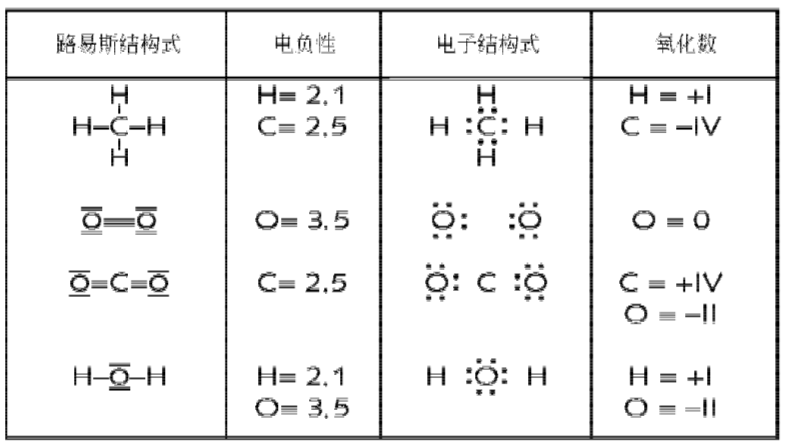
为了能准确推算共价键中原子的氧化数,必须在分子或离子的路易斯结构式中使用指定成键电子的方法(游戏规则)。
对于 I2 路易斯符号就变为:![]() 分配成键电子后,I的氧化数为 0。I的族数为7,在共价键的离子表示式中,I的价电子数也是7,族数减去价电子数:7-7 = 0。
分配成键电子后,I的氧化数为 0。I的族数为7,在共价键的离子表示式中,I的价电子数也是7,族数减去价电子数:7-7 = 0。
在反应CH4(g)+2O2(g)→CO2(g)+2H2O(I)中,
甲烷中H的氧化数:+I
水中的 H:+I
甲烷中的 C:-IV
二氧化碳中的 C:+IV
氧气中的 O:0
二氧化碳和水中的O:-II
下图为推算氧化数的示意图:
介绍了“原子的氧化数”概念后,我们就可 理解为什么通常把电荷转移反应称为“氧化还原反应”或“氧-还反应”。某一反应物中,一个原 子由于释放了(价)电子,氧化数增大,我们称这个原子被氧化,这个反应物总体上起了还原剂的作用。放出的电荷会被某(其他)原子吸收进 某(另一)反应物中。我们则说这个原子被还原,这个反应物总体上起了氧化剂的作用。
重 点:
在氧-还反应中,还原剂释放的所有电子都必须被氧化剂吸收。因此,氧-还反应中,氧化剂和还原 剂的化学计量数必须配平。符号 Red 和 Ox 分别代表还原型和氧化型。
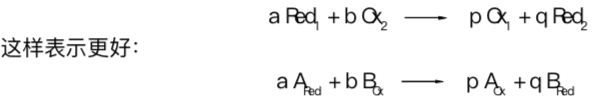
此外,由图 R05 我们可以看到,大体上,这些平衡反应(一般是自发反应)都是向着较强氧化剂和较强还原剂变为较弱氧化剂和较弱还原剂的方向进行。课堂上所用的推算氧-还反应计量数方法通常都是以氧化数分析为基础。不过,常见的原子守恒法也用在大多数氧还反应中。
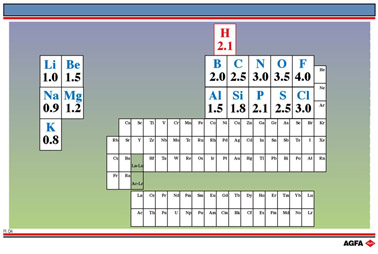
电负性数值
原子吸引共价键中成键电子的能力用原子的电负性来度量。高电负性的原子吸引电子,使其偏离低电负性原子。
电负性标度有几种。在鲍林电负性标度中,指定氟的电负性数值为4.0,通过将其他元素与氟的电负性进行比较,分别得到其他元素的电负性数值。
还有另一种方法,按照任意标度,元素的电负性表示为:在不同元素原子所形成的共价单键中,某元素原子对成键电子吸引作用的相对大小。
图 R04 列出了部分元素的鲍林电负性数据。
讨论氧还反应时,我们可以看到推算氧化数非常重要。
因此,对某些元素,具有良好的电负性数据预备知识,与具有其电子构型(价电子的数目)知识同等重要。此外,这些值很好记:从Li为1.0开始,一直到F,元素电负性数值依次增大 0.5。从K到Cl,除了最后两种元素S和Cl外,元素电负性值依次增大0.3。在这个标度中,H的电负性值为2.1。所以H不是金属,而是非金属!