R05 金属半反应方程式的排序
目标:依据金属的标准电极电势 |
一个半反应方程表示一种物质处于平衡状态,该物质具有其氧化形式或还原形式。根据 IUPAC的推荐,半反应方程式通常写成还原反应的形式,将某种物质写在方程式的左边,该物质的还原形式写在方程式右边。例如:
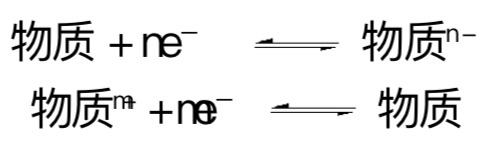
物质的还原形式指的是,相对于某元素被氧化的物质,一个物种中的该元素处于较低的氧化态。铜片与二价铜离子溶液达到平衡时的半反应方程式为:
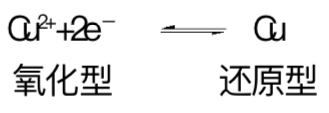
某溶解气体与其离子处于平衡状态的方程式为:

这些所谓的氧化还原电对具有自发地给予电子的能力,或者接受其他物质电子的能力,这决定于其给 予电子或接受电子的可能性。将不同的氧化还原电对放在一起,观察所发生的氧化还原反应,可以定性地 确定某特定氧化还原电对的这种能力。
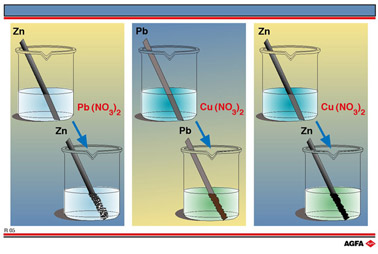
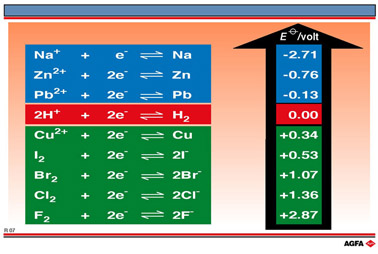
让我们看看Zn2+/Zn, Pb2+/Pb 和 Cu2+/Cu 这些氧化还原电对。图R05列出了三个简单的氧化还原反应。第一个是锌棒在Pb(NO3)2(硝酸铅) 溶液中将二价铅离子还原为铅,铅的氧化数由+II 变为 0。枝杈状的铅晶体看起来像一棵铅“树”。
同时,锌被氧化为二价锌离子,氧化数由 0 变为 + II。
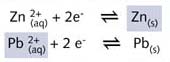
将这两个半反应方程式(上:右侧;下:左侧)相加,电子相消,得到总的氧化还原反应:
![]()
因此我们能得出结论: Zn2+/Zn 半反应的还原性比Pb2+/Pb
半反应的强。
第二个实验是铅棒将二价铜离子还原成铜金属, 铜的氧化数由+II变为0,可看到溶液的蓝色消失。同时,铅本身被氧化二价铅离子,铅的氧化数由 0 变为 + II。随着铜在铅棒上沉积,铅棒变成褐色。
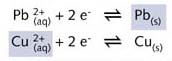
将这两个半反应方程式相加,得到总的氧化还原反应方程式:
![]()
这说明铅半反应的还原性比铜半反应的强。 第三实验是锌棒将二价铜离子还原为铜金属,铜的氧化数由+II变为0,使原先的蓝色溶液变成无色, 红棕色的铜金属在锌棒上沉积出来。同时,锌本身被氧化为二价锌离子,氧化数由0变为+II。

将这两个半反应方程式相加就得到总的氧化还原反应方程式:
![]()
由此我们能得出结论:Zn2+/Zn 半反应的还原性比 Pb2+/Pb 半反应强,而Pb2+/Pb 半反应的还原性又比Cu2+/Cu 半反应强。