R06 非金属的半反应方程式表
|
目标:按照卤素的氧化能力排列一些卤素氧化还原反应。 |
在周期表右上方,我们找到卤素家族:氟、氯、溴和碘。它们通常都是以双原子分子形态存在。在自然界很少发现游离态的卤素(希腊语词义是盐卤)。这并不意味着形成双原子分子的化学键弱,而是反映了卤素容易形成卤化物离子这一事实。
![]()
这是一个发生电子转移的氧化还原反应。卤素是公认的氧化剂,说明卤素/卤离子氧化还原电对具有接受其他试剂电子的潜能,即氧化那个物质的潜能。
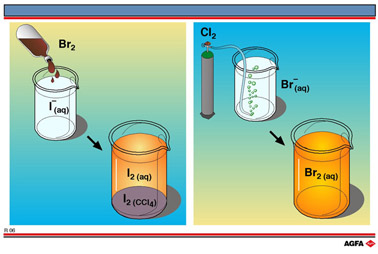
将两个不同的 X2/2X- 氧化还原电对放在一起,可以定性地确定某X2/2X-氧化还原电对相对于其他X2/2X-氧化还原电对的潜能。两个简单的氧化还原反应实验如图R06所示。
图R06的左边部分表示褐色液体Br2与碘水混合,得到浅褐色溶液,表明生成了少量碘。碘水可用碘化钾(KI)配制。为了更令人信服地证明碘的存在,可以加入少许四氯化碳(CCl4) ,然后振荡容器,静置几分钟后,底部的 CCl4层显示出I2的紫色,而水层的褐色几乎褪尽。另外,也可以加入几滴淀粉溶液,溶液变为蓝黑色,标志碘的存在。发生的总反应如下:
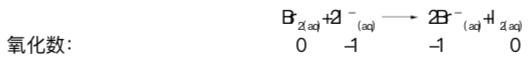
反映中Br2(aq)将氧化为I2(aq), 自身被还原为![]() 。因此,Br2(aq)是氧化剂,
。因此,Br2(aq)是氧化剂, ![]() 是还原剂。
是还原剂。
Br2(aq)/2Br- 半反应的氧化性较强,两个半反应可以写成:
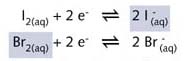
在图 R06 所示的反应中,浅绿色气体氯气((Cl2), 通入无色溴化钠 (NaBr水溶液中,得到浅褐色的溴溶液。同样,加入少许四氯化碳并振荡容器可以加深溴的颜色。由于溴在CCl4中比在水中溶解得好,底部的CCl4变为褐色。与碘分子相同,溴分子是非极性分子,因此在非极性溶剂CCl4中的溶解度比在强极性溶剂水中大。该反应可用两个半反应方程式表示:
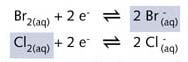
由于氟与水发生剧烈的氧化还原反应,生成HF气体,因此不可能像氯一样用这样简单的反应来说明。
I2, Br2, 和 Cl2, 也能与水反应,但是不那么剧烈。可以设想,以 F2(aq)
为氧化剂,![]() 为还原剂的氧化还原反应可以用以下半反应式表示:
为还原剂的氧化还原反应可以用以下半反应式表示:
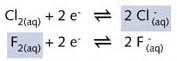
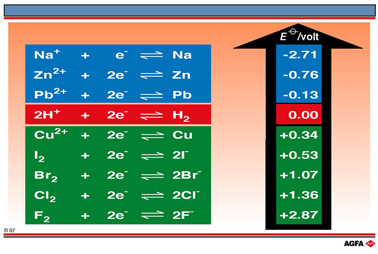
由这些实验可以得出结论:在四个卤族元素中,碘的氧化性最弱,氧化能力(即X2/2X-电对接受电子的可能性)的顺序为:
碘 < 溴 < 氯 < 氟
尽管这些简单实验在标准电极电势所规定的温度、压力条件下并不都能明显地显示出来,它们仍可令人信服地证明非金属卤族元素氧化能力的次序。
注意:当使用任一卤族元素时,必须事先注意所有的安全事项。