R07 标准电极电势表
目标:说明怎样用有限的氧化还原半反应标准电极电势表来解释许多实验结果,并进行预言。 |
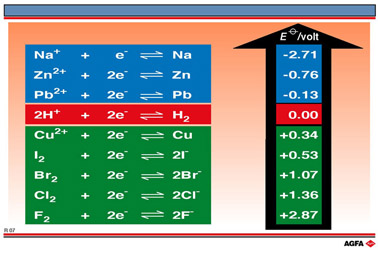
图 R05 说明了氧化还原电对的还原能力(即失去电子的能力)按以下顺序增大:
![]()
图 R06 说明了卤族电对的氧化能力(即接受电子的能力)按以下顺序增大:
![]()
以上得到的都是氧化还原电对的相对还原能力和相对氧化能力的定性信息。测定氧化还原电对的标准电极电势,可以定量表征这种能力。半反应的标准电极电势选取标准氢电极为参照物。
标准氢电极
按照惯例,在单位有效浓度,298 K,氢压强为1 atm(101.3 kPa)(译者注:现定为100 kPa)的 条件下,标准氢电极的标准电极电势为0 V。将镀铂铂电极插入1 mol·L-1 H+溶液中,构成标准氢电极。1 atm的氢气通到铂电极上,在铂的表面,氢气与氢离子建立起平衡,
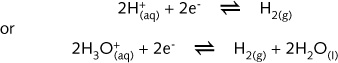
从而在铂表面上产生一个电势,规定其值为0 V。
标准电极电势的测定
用一个盐桥,将一个半反应式所表示的电极与标准氢电极相连,用校正好的电势计或高阻抗伏特计读出电势差,这样就测得了该电极的标准电极电势。习惯上,标准氢电极总是放在左边。 测定标准电极电势的电池结构与所涉及的物质有关。对于金属/金属离子电对,在25°C下,金属作为电极插入到其离子浓度为1 mol·L-1的溶液中。若是离子/离子电对,在25°C下,以铂作为电极,将其插 入到两种离子浓度均为1 mol·L-1的溶液中。对于气体/离子电对,在25°C下,铂电极插入到离子浓度为1 mol·L-1的溶液中,压强为1 atm的气体通到铂电极上。
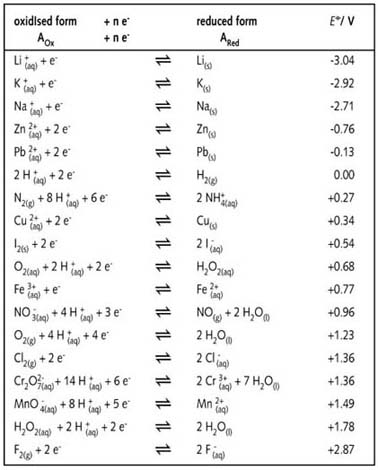
标准电极电势表
当将标准电极电势 ![]() 列成表时,习惯上将还原性最强的氧化还原电对写在表的上方,氧化性最强的电对写在下方。
列成表时,习惯上将还原性最强的氧化还原电对写在表的上方,氧化性最强的电对写在下方。
图R07中的标准电极电势表给出了氧-还半反应的 ![]() 值,这些数值是以标准氢电极为参照物的实验数据。
值,这些数值是以标准氢电极为参照物的实验数据。
可以看到,在表上部,氧化还原半反应的E 值为负值,绝对值大,而表底部的半反应则是 ![]() 值为大的正值。强还原剂(即氧化性最弱的电对,如Na+/Na和Zn2+/Zn)的
值为大的正值。强还原剂(即氧化性最弱的电对,如Na+/Na和Zn2+/Zn)的 ![]() 具有最大的负值。最弱的还原剂(即氧化性最强的电对,如Cl/Cl-和F/F-)的
具有最大的负值。最弱的还原剂(即氧化性最强的电对,如Cl/Cl-和F/F-)的 ![]() 具有最大的正值,列在表的底部。
具有最大的正值,列在表的底部。
标准电极电势表的应用
应用标准电极电势表中的 ![]() 数据,可以预言课堂实验的结果,也可以解释以氧化还原半反应为基础的各种工业生产过程。
数据,可以预言课堂实验的结果,也可以解释以氧化还原半反应为基础的各种工业生产过程。
工业上,将氯气通入溴水中来生产单质溴。由于产生单质氟的工业设备费用太高,因此这一原理不能用于工业生产单质氯。其他氧化剂,例如MnO4-,可以用于实验室规模制氯气,但也由于费用太高而不能大规模使用。
工业生产氯气的方法是电解氯化钠水溶液。该过程是非自发的,必须持续提供电能。由于不存在比氟更强的氧化剂,所以电解是生产氟的惟一方法。
由标准电极电势表也可以理解,为什么在中性的水中,碱金属(例如钠)与氢离子的反应如此剧烈。
在表中,这些金属的半反应方程式位于氢离子半反应方程式的上方,因此可以将氢离子还原。而锌只有在外加氢离子时(即在酸性介质中)才能还原水(见图 R09,离子浓度对电极电势的影响)。
标准电极电势表可以定量解释电对Zn2+/Zn, Pb2+/Pb 和 Cu2+/Cu的氧化能力差别。
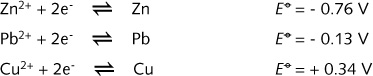
并定量解释图 R05 中所预言的氧化还原反应。习惯上,测量电化学电池的电池电势 (Ecell)即电动势(e.m.f.)时,总是将更负的电极体系(阳极)置于左侧。结果得到:
结果得到:

因为电池电势等于右侧电极的电极电势减去左侧电极的电极电势。
根据Zn2+/Zn
和 Cu2+/Cu 半电池的标准电极电势,可以预料,在二者组合成的电池中,金属锌作为阳级(Zn氧化为Zn2+), Cu2+作为阴极(氧化剂,自身被还原)。因此:
![]()
即便不以外界(持续地)给体系提供能量,由于Ecell的正值较大,可以确保Zn和Cu2+之间的氧化还原反应能自动持续地发生。
重要的还原剂与重要氧化剂
前面实验涉及了一些氧-还半反应方程式,下表列出了更多的半反应方程式。它们按照IUPAC惯例书写,所有数值都是标准电极电势。字母(g)、(l)、(s)和(aq)分别表示物理状态:气体、液体、固体和水溶液,书写时与符号保持相同高度,紧挨在符号之后。例如: Li+(aq) 或 ![]()
既具有氧化性又具有还原性的化合物
有时,一个半反应方程式所表示的物质既能做氧 化剂,又能做还原剂,这由反应中的其他离子以及介质类型所决定。例如,过氧化氢既可以是氧剂又可以是还原剂。在标准电极电势表中,物质H2O2出现在上部右侧和下部左侧:
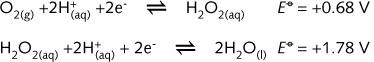
一个化合物同时发生氧化反应和还原反应的过程称为歧化。事实上,在储存过程中,歧化并不影响中性过氧化氢水溶液。只含有H2O2 的水溶液是稳定的。只有当H2O2 与某些催化剂(例如Fe2+, Fe3+, I-, MnO2等等)接触时,它才会分解。H2O2通常用于清洁隐形眼镜,漂白头发,以及用作杀菌剂。
(NH4NO3) 是另一个会发生歧化的化合物,但它的歧化与所用介质类型无关,不需要催化剂。用以上标准电极电势表可以解释这一事实。![]() 位于表的右上侧,因此是一个强还原剂。硝酸根离子(
位于表的右上侧,因此是一个强还原剂。硝酸根离子(![]() )位于表的左下侧,因此是一个强氧化剂。在水溶液中,或在固态,
)位于表的左下侧,因此是一个强氧化剂。在水溶液中,或在固态,![]() 和
和 ![]() 都可以稳定存在。但是,震动足以引发歧化反应或自氧化还原反应。多年来,硝酸铵都用作肥料,但它也是威力强大的炸药,硝酸铵受热时发生分解:
都可以稳定存在。但是,震动足以引发歧化反应或自氧化还原反应。多年来,硝酸铵都用作肥料,但它也是威力强大的炸药,硝酸铵受热时发生分解:
![]()
重铬酸铵(NH4)2Cr2O7(s)
受热也发生类似的分解反应,引人注目的现象是,橙色晶体变成一大堆绿色片状粉末。
热力学可能性与动力学现实性
以上,我们已经见到了这样一些还原剂与氧化剂,即使将它们强烈混合,也不会发生电子转移,即不发生氧化还原反应。例如H2O2,它并不自发分解;又如NH4NO3,它并不自动发生爆炸。
事实上,一个试剂位于标准电极电势表的右上部,而另一个试剂位于其左下部,这并不保证会自动持 续发生氧化还原反应。
有时反应的发生需要更多条件:可以是一种震动,一种冲击力、一种搅拌的形式,还可以是温度或催 化剂。H2O2可以安全储存在(深色)瓶中,一旦加入少量催化性物质,它就会自发分解。由标准电极电势 表可以看出二价铁盐和三价铁盐可能产生的影响:它们的半反应的标准电极电势位于过氧化氢两个半反应 的标准电极电势之间。
标准电势表并不能确切地预言哪一个自发的氧化还原反应能够真正发生。标准电极电势表反映的是氧化剂与还原剂按照自发方式作用的热力学趋势。不论电对的 ![]() 值相差有多么大,也并不说明该氧化还原 反应进行的动力学问题,即该反应真实发生的现实性问题,以及反应进行的速率。
值相差有多么大,也并不说明该氧化还原 反应进行的动力学问题,即该反应真实发生的现实性问题,以及反应进行的速率。
如果将热力学上应该发生自发反应的氧化还原电对组合后,并不能看到反应发生的现象,这可能意味着存在动力学问题,也可能意味着金属表面形成了不溶盐。当铅放在锌离子水溶液中时,后一情况尤其可能存在。这时,应该仔细选择锌盐,在这儿硝酸锌可能最适宜。