R08 浓度与电极电势

|
目标:说明真实电极电势与标准电极电势以及试剂浓度之间的关系。 |
当以标准氢电极为参照物时,测得半反应的标准电极电势以V为单位表示。对于标准氢电极:
![]()
25°C下,
![]() = 0 V,氢的分压为1 atm(101.3 kPa),H+浓度为1mol·L-1(即pH = 0)。
= 0 V,氢的分压为1 atm(101.3 kPa),H+浓度为1mol·L-1(即pH = 0)。
温度、气体分压(若试剂为气体)以及半反应式中有关试剂浓度都对半反应的电势产生影响。
德国化学家与物理学家能斯特第一个发现了这些因素之间的关系。1920年,由于他对热力学和电解质溶液研究的贡献,能斯特获得诺贝尔奖。
能斯特指出:

loge 10,ln转换为lg的换算因子为2.3。
![]()
锰的氧化数从 ![]() 中的+VII 变为 Mn2+ 中的 +II,由此看出,这是一个5电子还原反应。该反应的商
中的+VII 变为 Mn2+ 中的 +II,由此看出,这是一个5电子还原反应。该反应的商
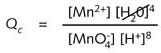
不要将符号Qc与反应在平衡下测得的平衡常数相混淆。反应商仅仅对应反应中某时刻的浓度,体系不一定处于平衡状态。
对于溶剂水,公式中其浓度因子可以忽略,因为它的取值可以为 1(见 DIDAC-2 中化学平衡模块)。
因此,25°C下:
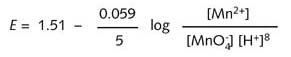
如果已知相关浓度,则25°C下的E值就可以由公式计算出来。
由以上公式可以看出,E值与氢离子浓度有关,即与溶液的酸度有关。当氢离子浓度增大,即pH降低时,E 值变得更正,还原剂的氧化强度增大。
注释:
对一个pH相关的还原剂,低[H+]或高[OH-]使还原能力增强(E值更负)。
.