R09 浓度与电极电势

目标:说明浓度差使两个相同氢电极组成的电池产生电势差。 |
图R09描述的是,两个氢电极作为半电池,构成一个电化学电池。两个氢电极仅仅存在盐酸浓度的差别:左边半电池为0.1 mol·L-1,右边半电池为1 mol·L-1。在25°C下,1 atm(1 013 hPa)的氢气通到两个铂电极上。右边电极为标准氢电极,![]() = 0 V。左边半电池的pH为1(H+浓度为 0.1 mol·L-1)。两个半电池的半反应方程式分别为:
= 0 V。左边半电池的pH为1(H+浓度为 0.1 mol·L-1)。两个半电池的半反应方程式分别为:
![]()
这是一个双电子反应,其Qc的表示式为:
![]()
伏特计检测出两个半电池之间存在电势差。由于所有其他因素都相同,该电势差只能由浓度差造成。左边非标准态半电池的真实电极电势可由能斯特方程式确定:
![]()
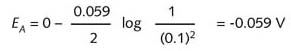
数据表明,左边半电池的还原性比右边标准半电池的强。左边半电池的氢离子浓度越低,即pH越高, 其电势越负。该电池的电势Ecell为阴极(右边半电池)的电极电势EC与阳极(左边半电池)的电极电势 EA之差。
![]()
可以看出,所得的正值与用能斯特方程计算出的
EA在数值上相等。通常规定:一个电化学电池反应按照自动发生的方向书写时,其 Ecell 为正值。自发反应的 ![]() 为负值。因为
为负值。因为![]() = -nFEcell ,显然,若 Ecell
为正值,
= -nFEcell ,显然,若 Ecell
为正值,![]() 为负值。
为负值。