R10 非标准电极电势.

目标:比较两个极常见半反应的标准电极电势与真实电极电势。 |
图R10列出了两个半反应的E值,以及在各种pH下的真实电极电势E:
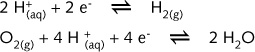
由于介质的pH不同时,相关物质具有不同的存在形态,每一个半反应方程式都存在四种不同的表示式:两个碱式(为OH-),两个酸式(为H+)。但只有三个E 值。
对图R10中上面的一套E值,即半反应 2H+/H2 :

由于氢离子浓度不为1 mol·L-1,中间两个数据为非标准电极电势,因此,表中注明了浓度。由于空间的限制,没有标出反应物的物理状态以及所用单位。严格说来,当反应物为气体、液体、固体或溶液时, 应标明(g)、(l)、(s)、(aq)。表的上端和底端所给数据为每一半反应的标准电极电势。四个过程的本质相同,都是氢H由氧化数+I 还原为0。E值可由标准电极电势中查到,而非标准电极电势(中间两个数据)则查不到。25°C下,半反应 2H2/H2 的非标准电极电势可用能斯特方程式计算得到:
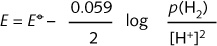
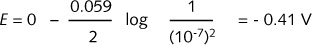
对图 R10 中下面的一套E值,即半反应 O2/2H2O :

相应的过程为氧由氧化数0还原为 -II。同样地,非标准电极电势可用能斯特方程式算得。
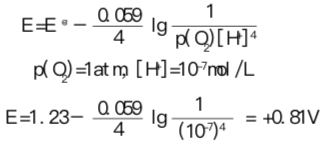
注释:
中性水溶液中发生的大多数反应都是在非标准电极电势条件下进行的。对半反应2H+/H,所用电极电势为-0.41V,而半反应O/2HO的该值为+0.81V。图R10表明,不论半反应写成为OH-形式还是H+形式,E的数值不变。
可以得出结论:在水中,在pH为7时,与标准条件相比,氢为更强的还原剂,氧为更强的氧化剂。在中性溶液中,氢离子浓度极小,因而氧化金属锌的可能性很小。在酸性溶液中,氢离子浓度高,可以氧化金属锌。
这种模式也可扩展到讨论氧气。因为酸性溶液的氢离子浓度更高,与中性溶液相比,在酸性溶液中,氧气更可能将铁氧化。