R11 电解池与原电池
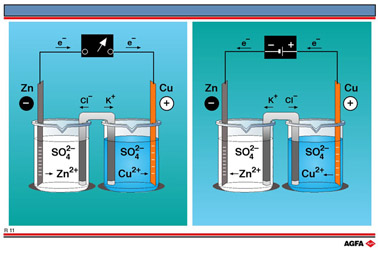
目标:说明原电池与电解池间的关系,即自发氧化还原反应与非自发氧化还原反应间的关系。 |
像大多数化学反应一样,电子转移的反应原则上向方程式所示的两个方向都可以进行,甚至同时向两个方向进行。在原电池中,电极反应自发进行,直到一种反应物耗尽,或直到两个半电池的电极电势变为相等。反之,在电解池中,一直提供电能以维持一个氧化还原反应,否则反应就不会发生,这就是所谓的非自发氧化还原反应。
按照惯例,一个电池,不论是原电池还是电解池,总是将负极表示在左侧。也就是说,在原电池中,自发氧化还原反应的电子总是表示为从左侧流向右侧,而电解池中的外加电子则表示为由右侧流向左侧。
图R11中的两个电池都由电对Zn2+/Zn和Cu2+/Cu 组成。左侧表示一个原电池的结构。这是一个丹尼尔电池,发生自发氧化还原反应,电子由Zn2+/Zn组成。左侧表示一个原电池的结构。这是一个丹尼尔电池,发生自发氧化还原反应,电子由Zn2+/Zn向Cu2+/Cu电对,直到金属锌或二价铜离子耗尽。
R11的右侧表示一个电解池。电子由一个蓄电池提供,从Cu2+/Cu电对流向Zn2+/Zn电对,维持一个氧化还原反应,直到金属铜或二价锌离子耗尽。
电池中发生的氧化还原反应归纳如下:

外部持续提供的电能推动氧化还原反应发生。本例中,锌离子被迫氧化金属铜,后者反过来成为一个还原剂。
在该电解池中,锌电极为阴极,铜电极为阳极。阴极需要持续提供电子,电子来自于电流。
阴极与阳极
阴极是发生还原反应的电极。在原电池中,阴极由阳极获得电子,用正号表示。但是在电解池中,阴极吸引阳离子,并向其提供电子,将其还原。电解池的阴极用负号表示,因为电源向该极提供电子。
阳极是发生氧化反应的电极。在原电池中,阳极向阴极提供电子,因此用负号表示。但是在电解池中,
阳极吸引阴离子,并将其氧化。电解池的阳极用正号表示,因为它连接到电源的正极上。

在用相同氧化还原电对作半电池的原电池和电解池中,例如图R11所示的装置,原电池的阴极和阳极电对在电解池中分别变为阳极和阴极电对。
自发与非自发氧化还原反应
用ARed - BOx 与 AOx - BRed表示两个共轭电对,在ARed + BOx 和 AOx + BRed混合物中,可能发生以下反应:
1. 彻底进行的自发反应
![]()
一个自发反应的主要要求是,吉布斯自由能小于0和熵增。较强还原剂与较强氧化剂作用,转变为较弱还原剂和较弱氧化剂的反应满足这些条件。在图 R07 的氧化还原电对电极电势表中,强还原剂出现在上部右侧,而强氧化剂出现在底部左侧。
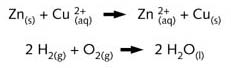
丹尼尔电池的半反应(见图R03和R11)进行完全,无需使用催化剂或外加能量。若将两种反应物直接混合(见图R05)也是如此。只要存在反应物,这种反应就一直进行下去。
氢气和氧气生成水的反应也可以用粗箭头表示,因为只有当至少一种反应物用完时,反应才停止。但是,该反应的反应速率极慢,需要用催化剂或升高反应物温度来引发。不过,一旦反应开始,它就进行彻底,不再需要外加能量。这是一个反应速率极慢的自发氧化还原反应的例子。这些反应向着由较强还原剂、 较强氧化剂转变为较弱还原剂、较弱氧化剂的方向进行(见图 R10)。
2. 自发的平衡反应
![]()
尽管都是由较强还原剂、较强氧化剂转变为较弱还原剂、较弱氧化剂,氧化还原反应并不总能进行到底。如果氧-还半反应电对具有相近的标准电极电势,在反应过程中真实电极电势可能逆转,当电极电势相等时,反应达到平衡。在下面的反应中,
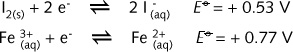
在某种浓度下,还原/氧化能力的差别很小,以致相关的吉布斯自由能变化导致反应向两个方向都有可能进行。这时体系可视为达到平衡。这种反应称为可逆平衡氧化还原反应,可用双向箭头表示。
![]()
反应向两个方向都是自发的(不需供给能量),并且都不需提供引发能量。当吉布斯自由能不可能再进一步降低时,体系达到平衡;而当一种试剂用完时,体系是不能达到平衡的。
3.
非自发反应
像任何化学反应一样,氧化还原反应可以向两个方向发生,直到一种试剂耗尽。例如,让金属铜与锌离子反应,金属铜可能变回铜离子,而锌离子反过来变回锌金属。但是这种氧化还原反应并不自动发生。整个过程都需要外部提供能量。这称为非自发氧化还原反应,伴随的是吉布斯自由能增大。为了预言两个 物质是否会发生自发氧化还原反应(可以在一个短期准备过程之后,或者在催化剂的帮助下),我们使用以下实用规则:原则上,电极电势表中右上方的物质可以与左下方的物质发生自发氧化还原反应。
按照由半反应组成的电化学电池存在电动势的观点,该定性规则也可定量表示:只有当电动势结果为 正值时,自发氧化还原反应才可能发生。为了测定电动势,即电化学电池的电势 (Ecell),习惯上用阴极的电 极电势减去阳极的电极电势。并非所有氧化还原反应都能通过外部提供能量而进行。可能存在难以克服的 动力学困难和 / 或技术困难。给体系提供能量的一种简单方法是使用电流,即电子流。如果与原电池(例如丹尼尔电池)产生能量相反,人们提供能量给一个电池,则该电池就叫做电解池。外部提供能量电流, 使图R07中标准电极电势表所预言的氧化还原反应发生。持续地向含有锌离子和铜金属的“电池”中提供 电能,就可能获得锌金属和二价铜离子。在这种情况下,弱氧化剂(一个还原性较强的电对中的最高氧化形式)必须与一个弱还原剂(一个氧化性较强的半电池中的最低还原形式)反应。
注释:
外部能源所提供电压的伏特数常常需要大于两个电极电势之差△U。高电压可能使水溶液中存在的其 他试剂也发生氧化还原反应。在图R11的例子中,硫酸根离子![]() 被吸向铜棒,是水分子中的氧被氧化,而不是
被吸向铜棒,是水分子中的氧被氧化,而不是![]() 中的硫被氧化,生成氧气。电解水时,因使用了H2SO4酸化水,也能观察到这一现象。
中的硫被氧化,生成氧气。电解水时,因使用了H2SO4酸化水,也能观察到这一现象。