R12 大气腐蚀
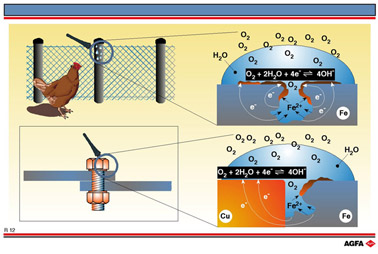
目标:说明大气腐蚀是如何发生的,是由哪些氧化还原半反应造成的。 |
多少世纪以来,腐蚀就是家庭、花园、 交通工具(从自行车到小汽车)、航运、工业和地下管道输送都必须面临的一个严重问题。腐蚀的后果实在是太熟悉了,有些东西不得不换掉,顾客越来越不满意,还有一些其他的有害经济后果。每年英国钢产量的八分之一都用于替换腐蚀掉的铁。
为了抗腐蚀,常常需要耗资进行表面处理,例如,涂漆、镀锌、镀锡等等,这些方法经常使用到一些对土地、水和空气产生严重污染的产品。
铁的锈蚀
腐蚀是一个广泛存在的问题,其可用图R12所表示的氧化还原反应来解释。图的右上侧表示与水相接触的铁表面,水中溶有少量氧气。
此时,一个腐蚀电池所必需试剂都存在(这是一个造成腐蚀的简单电化学电池)。这种因腐蚀而形成的腐蚀电池存在一个阳极区,一个阴极区,一个合适的电子传递介质(金属本身),以及可供离子在其中移动的水溶液。为了分析阳极区与阴极区是如何形成的,下面列出了重要的电化学半反应:
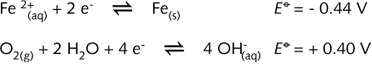
由以上 ![]() 数据可以推测,金属的表面铁为阳极。水滴的上部与空气中的氧气接触,因此此处的氧气浓度比水滴本身的大。该较高浓度区域是主要的阴极区。能斯特方程式(R08)表明,随着氧分压增大,氧化电势也增大。
数据可以推测,金属的表面铁为阳极。水滴的上部与空气中的氧气接触,因此此处的氧气浓度比水滴本身的大。该较高浓度区域是主要的阴极区。能斯特方程式(R08)表明,随着氧分压增大,氧化电势也增大。
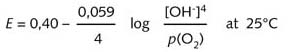
![]()
水中生成的铁(II)离子碰到快速扩散的氢氧根离子,二者发生反应,生成不溶的氢氧化亚铁。氢氧化亚铁随后被空气氧化为三价铁的氧化物。
![]()
阴极或阴极区并不仅仅是铁金属。铁和铁的氧化物 FeO、Fe2O3以及氢氧化物Fe(OH)2、Fe(OH)3形成复杂的阴极表面,称为铁锈。在阳极区与阴极区之间,存在持续不断的扩散过程。由于阴极从空气中不断获得氧气,这种腐蚀称为大气腐蚀。
腐蚀过程的几个特性:
• 因为盐提供离子,当它们溶于水后,推动体系中已经存在的离子迁移。因此,如果水中含有盐分,腐蚀将更严重。
• 只有当生成的铁锈具有导电能力时,腐蚀才能持续发生。但是,如果将铁掺入到合金钢(例如不锈钢,18% Cr,8% Ni)中,铁的表面形成一层CrO2隔离层。由于电子不能传递,即使已经发生的腐蚀过程也会立即停止。
• 如果存在酸,产生的H+与腐蚀过程中产生的氢氧根离子结合生成水,这将导致生成更多氢氧根离子,使腐蚀更加严重。
铜铁连接处的腐蚀
当两种金属(其中一种是铁)连接到一起时,要特别注意防止铁的腐蚀。在R12的左下部,用铜螺丝钉连接两块铁,铜金属比铁的还原能力弱,可以认为氧化还原电对为:

两个电对的![]() 数据非常接近。如果为非标准条件,
数据非常接近。如果为非标准条件,![]() 的顺序可能逆转,原来的氧化能力与还原能力都失去。铜的腐蚀程度极小,但它是优良的电子导体。因此,存在铁时,铜提供了一个良好的阴极表面,.这增强了铁的腐蚀程度。当两块铁都腐蚀尽之后,铜螺丝钉仍然存在!
的顺序可能逆转,原来的氧化能力与还原能力都失去。铜的腐蚀程度极小,但它是优良的电子导体。因此,存在铁时,铜提供了一个良好的阴极表面,.这增强了铁的腐蚀程度。当两块铁都腐蚀尽之后,铜螺丝钉仍然存在!