BP09 溶菌酶——一种典型的酶
目标:以溶菌酶为例,说明酶的空间结构与其功能之间的联系。 |
为了使细胞内的化学反应以一个可接受的速率进行,细胞使用了一系列催化剂,或称为酶。这些酶,大多是蛋白质,可以使反应加快106 倍。在反应过程中,底物结合到酶的活性部位上。这种酶-底物之间 的相互作用是非常专一的:一种酶的底物不会结合到另一种酶的活性部位。这种专一性行为是由于底物是 那些与其结合的凹槽或裂口的补充形态。通常称其为锁钥规则。
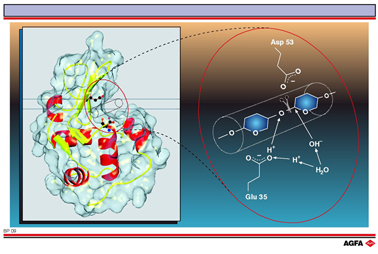
溶菌酶的活性区域位于较深的一个凹槽内,它刚好容纳将被分解的多糖链的6个糖单元。 催化机制也可以通过晶体结构的研究而确定。谷氨酸35和天冬氨酸53在这里起着重要的作用。它们位于与活性结合的糖链的不同侧面。谷氨酸35的羧基贡献了一个质子给糖单元4和5之间的葡糖苷氧原子 (左图),键即在此处断裂。由于天冬氨酸的羧基的靠近,使得右侧糖环中的带正电的碳原子1(碳正离子) 被稳定化了。碳正离子与溶剂中的羟基作用,使谷氨酸 35 再一次质子化,被分解的链离开活性区域。
X 射线衍射使确定很多酶的功能成为可能。