CB10 键长和键角
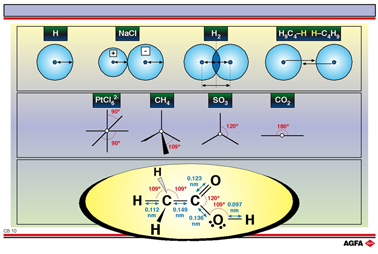
目标:说明一个分子的空间结构是由核之间的距离以及化学键之间的角度决定的。 |
一个分子的空间结构主要是由分子中原子的性质、它们的电子结构和原子间成键的类型决定的。这种成键过程最终得到了一个更稳定的分子,在固相时分子由晶格点阵构成,其中的原子和离子之间具有一定的键长和键角。尽管原子、离子和分子存在相对振动,甚至在固态也如此,仍然具有平均键长和键角,并且在这个限度内,振动仍然可以进行。
对于一个孤立的原子(如 H),我们可以说出它的原子半径。尽管如此,孤立的原子的原子半径很难由实验确定,因为一方面完全孤立的原子并不存在,另一方面原子周围的电子云并没有严格定义的界限。
因此,原子的原子半径定义为两个相同原子形成的分子中原子核间距离的一半。H原子的原子半径就是 H2 分子中两个H核之间距离的一半。对于铁,原子半径是在铁的金属晶格中两个相连的铁原子核之间距离的一半。
对于固体离子化合物来说(如 NaCl),可以用X射线衍射技术确定离子晶格的离子半径。正离子的离子半径(阳离子,如
Na+) 比相应的原子半径小;负离子的离子半径(阴离子,如Cl-) 比相应的原子半径大。
紧密聚集在一起的分子之间产生更弱的结合力(见 CB13 和 CB15)。
这种分子间的作用力明显弱于分子内的化学键。分子间作用力发挥作用的范围可以通过实验来确定, 我们把这种作用力以其发现者命名为“范德华力”。
原子的范德华半径给出了分子外侧的原子和相邻的另一个原子发生相互作用的距离。
在化合物中最常见的键角是90°,109°,120°和180°。但这是对三个原子形成的孤立的分子而言的。由于分子内电荷密度以及原子大小的不同,键角会发生扭曲。插图给出了乙酸(醋酸,醋)分子的键长和键角的理想值。